Diagrama de fases
O diagrama de fases é um gráfico que representa os valores de temperatura e pressão que determinam a fase da substância. Essa representação gráfica nos permite identificar as características das substâncias, o seu estado físico, ou melhor, a sua fase, conforme variamos os valores da temperatura e da pressão. Cada substância tem suas próprias características, que as diferenciam umas das outras.
Leia também: Como as substâncias mudam de fases?
Resumo sobre diagrama de fases
- O diagrama de fases de uma substância é um gráfico com os valores de pressão e temperatura que determinam a fase da substância.
- Existem três fases: sólida, líquida e gasosa.
- O diagrama de fases é constituído de três curvas: fusão, vaporização e sublimação.
- A curva de fusão representa o equilíbrio entre a fase sólida e a fase líquida.
- A curva de vaporização representa o equilíbrio entre a fase líquida e a fase gasosa.
- A curva de sublimação representa o equilíbrio entre a fase sólida e a fase gasosa.
- Também há dois pontos importantes, o triplo e o crítico.
- Ponto triplo é o ponto de encontro das três curvas do diagrama de fases.
- Ponto crítico é o ponto em que, acima da temperatura crítica, a substância é gás; abaixo dela, a substância é vapor.
O que é diagrama de fases?
O diagrama de fases de uma substância é uma representação gráfica dos valores de pressão e temperatura que determinam a fase da substância (estado físico da matéria). Ele é constituído de três curvas, que separam as três fases: sólida, líquida e gasosa.
Como funciona o diagrama de fases?
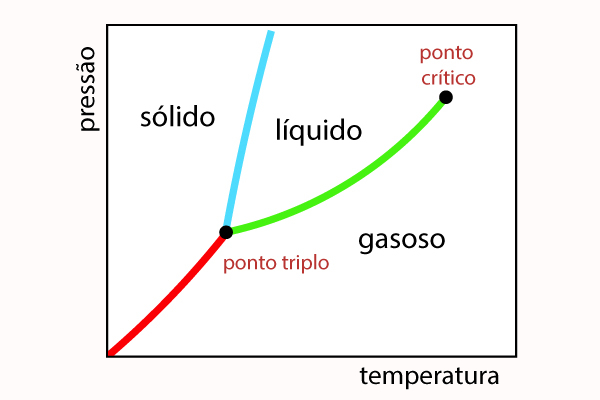
A figura seguinte representa um típico diagrama de fases de uma substância qualquer:
O diagrama de fases é um desenho no plano cartesiano, ou seja, um gráfico bidimensional com a temperatura no eixo das abscissas (a reta horizontal) e a pressão no eixo das coordenadas (a reta vertical). O gráfico é dividido por três curvas, que representam os equilíbrios entre diferentes fases:
- Curva de fusão: representa o equilíbrio entre a fase sólida e a fase líquida.
- Curva de vaporização: representa o equilíbrio entre a fase líquida e a fase gasosa.
- Curva de sublimação: representa o equilíbrio entre a fase sólida e a fase gasosa.
Veja também: Qual é o quarto estado físico da matéria?
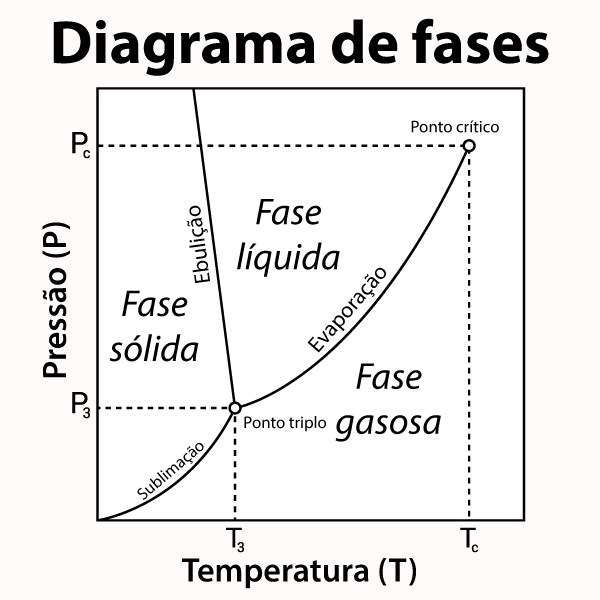
Elementos do diagrama de fases
Os principais elementos do diagrama de fases se constituem de três curvas e dois pontos importantes, as curvas de fusão, vaporização e sublimação; e os pontos triplo e crítico. Vejamos em detalhe o que cada um significa:
- Curva de fusão: para analisar a curva de fusão, é importante ter em mente que existem dois tipos de substâncias: as que se dilatam na fusão e que correspondem à maioria das substâncias; e as que se contraem na fusão, como a água, o bismuto e o ferro. Para as substâncias do primeiro tipo, um aumento da pressão implica um aumento da temperatura de fusão; já para as do segundo tipo, um aumento da pressão diminui a temperatura de fusão.
- Curva de vaporização: o processo de vaporização pode ocorrer de duas formas: por ebulição e por evaporação. Na ebulição, para cada substância em específico, um aumento da pressão acarreta um aumento na temperatura de ebulição. Já a evaporação é um processo lento que, ao contrário da ebulição, pode ocorrer em qualquer temperatura e em pressão atmosférica, como na evaporação de roupas estendidas em um varal ou os líquidos que evaporam facilmente (voláteis), como um vidro contendo perfume ou acetona.
- Curva de sublimação: sublimação é a passagem direta da fase sólida para a fase gasosa ou vice-versa, como acontece com a naftalina e o gelo seco. Para que uma substância pura sofra sublimação, é necessário que ela esteja sob uma pressão inferior à do ponto triplo.
- Ponto triplo do diagrama de fases: é o ponto de encontro das três curvas. Nesse ponto coexistem, em equilíbrio térmico, as três fases: a sólida, a líquida e a gasosa.
- Ponto crítico do diagrama de fases: na curva de vaporização, o ponto crítico corresponde a uma pressão e a uma temperatura crítica. Acima da temperatura crítica, a substância é gás; abaixo dela, a substância é vapor. Uma substância na fase gasosa não pode ser liquefeita por compressão isotérmica, ou seja, não passa da fase gasosa para a líquida apenas aumentando a pressão em temperatura constante.
Diagrama de fases da água
A figura seguinte representa o diagrama de fases da água H2O:

Note que o ponto triplo da água apresenta uma pressão de 0,006 atm e uma temperatura de 0,01 °C, enquanto o seu ponto crítico apresenta uma pressão de 217,75 atm e uma temperatura de 373,99 °C. Além disso, na pressão atmosférica de 1 atm, a água congela em temperaturas abaixo de 0 °C e entra em ebulição a partir de 100 °C.
Diagrama de fases do gás carbônico
A figura seguinte representa o diagrama de fases do dióxido de carbono, popularmente conhecido como gás carbônico CO2:

Note que o ponto triplo do gás carbônico apresenta uma pressão de 5,11 atm e uma temperatura de -56,4 °C, enquanto o seu ponto crítico apresenta uma pressão de 73 atm e uma temperatura de 31,2 °C. Além disso, na pressão atmosférica de 1 atm, o gás carbônico se apresenta no estado gasoso em temperaturas maiores que -78,5 °C.
Saiba mais: Qual a diferença entre substâncias e misturas?
Exercícios resolvidos sobre diagrama de fases
Questão 1. (UFCE) O esquema representa as três fases de uma substância pura, e as setas indicam algumas mudanças de fases possíveis. As setas x, y e z correspondem, respectivamente, a:

a) liquefação, vaporização e condensação.
b) fusão, vaporização e sublimação.
c) liquefação, condensação e vaporização
d) fusão, sublimação e vaporização
e) solidificação, liquefação e sublimação
Resolução: Alternativa B
Do sólido para o líquido ocorre o processo de fusão; do líquido para vapor, ocorre o processo de vaporização; e do sólido para o vapor, ocorre o processo de sublimação.
Questão 2. (Socied. de Cult. e Educ.-SP) Ao se solidificar, o bismuto apresenta um aumento de volume. O aumento da pressão em uma amostra de bismuto:
a) não altera o seu ponto de fusão.
b) reduz o seu ponto de fusão.
c) aumenta o seu ponto de fusão.
d) pode alterar o ponto de fusão, dependendo da forma geométrica do bismuto.
Resolução: Alternativa B
Para substâncias que diminuem ao se solidificar, um aumento da pressão diminui a temperatura de fusão.
Fontes
CARRON, Wilson; GUIMARÃES, Osvaldo. As faces da física (vol. único). 1. ed. Moderna, 1997.
HALLIDAY, David; RESNICK, Robert; WALKER, Jearl. Fundamentos da Física: Gravitação, ondas e termodinâmica (vol. 2). 9 ed. Rio de Janeiro, RJ: LTC, 2012.
NUSSENZVEIG, Herch Moysés. Curso de física básica: Fluidos, oscilações e ondas, calor (vol. 2). 4 ed. São Paulo: Editora Blucher, 2013.