Transformações cíclicas
No estudo da termologia dos gases perfeitos, encontramos quatro tipos de transformações particulares: a isotérmica, a isovolumétrica, a isobárica e a adiabática.
Em uma transformação isotérmica, a temperatura do sistema mantém-se constante e, em consequência, a variação de sua energia interna é nula, ou seja, ΔU = 0.
Em uma transformação isovolumétrica, o volume do gás mantém-se constante e, em consequência, não há realização de trabalho, portanto, ΔU = Q.
Em uma transformação isobárica, a pressão do sistema permanece constante. De acordo com a equação de Clapeyron, o volume e a temperatura serão proporcionais.
Em uma transformação adiabática não há trocas de calor entre o sistema e o meio externo. Dessa forma, toda energia recebida ou cedida é transformada em trabalho.
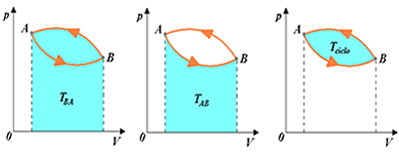
Porém, uma sucessão de transformações, tais que os estados inicial e final coincidam, é chamada de transformação cíclica ou fechada. Em um diagrama pressão versus volume, essa transformação cíclica é representada por uma curva fechada.
Em módulo, o valor do trabalho total trocado com o meio externo é determinado pela “área interna” à curva fechada representativa do ciclo. Vejamos a figura acima.
Não é difícil perceber que, ao desenvolver uma transformação cíclica, o sistema sempre realiza e recebe trabalho, sendo o trabalho total a soma desses trabalhos parciais. Em um ciclo, então, há trabalho realizado pelo gás e contra o gás. Assim, o trabalho total, ou líquido, do ciclo corresponderá à orientação do ciclo, no diagrama pressão versus volume.
- Quando o ciclo está orientado no sentido horário, o trabalho realizado é maior que o recebido, o que indica que o sistema realiza trabalho: portanto, T > 0.
- Quando o ciclo está orientado no sentido anti-horário, o trabalho recebido é maior que o realizado, o que indica que o sistema recebe trabalho: portanto, T < 0.