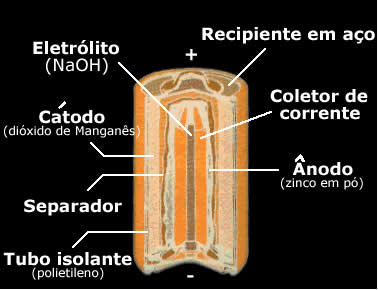
Pilhas alcalinas
As pilhas alcalinas são um tipo de pilha com a base de funcionamento muito parecida com a pilha seca de Leclanché, a pilha comum. A diferença consiste no fato de a pilha de Leclanché ser ácida em razão da hidrólise do cloreto de amônio (NH4Cl(aq)). Este sal é produzido de uma reação entre uma base fraca e um ácido forte, por isso, quando ele sofre hidrólise, o meio fica ácido.
Já na pilha alcalina, esse composto é substituído por uma substância básica, como o hidróxido de potássio (KOH) ou o hidróxido de sódio (NaOH). Nesse caso, a reação global e as semirreações que garantem o funcionamento dessa pilha são:
Ânodo: Zn + 2 OH → ZnO + H2O + 2e-
Cátodo: 2 MnO2 + H2O + 2e-→ Mn 2O3 + 2 OH
Reação global: Zn +2 MnO2→ ZnO + Mn 2O3
Essa alteração faz com que a pilha dure mais (cerca de 5 a 8 vezes mais que a pilha ácida). Isso se deve a pincipalmente três consequências do uso do hidróxido de potássio:

Fatores que fazem uma pilha alcalina durar mais que uma ácida.
O uso dessa pilha se torna melhor e mais seguro por ainda outro motivo: o eletrólito alcalino impede que ocorram reações quando a pilha não está em uso. Já na pilha ácida, se ela estiver armazenada dentro do aparelho elétrico, acontecerão reações que provocam a corrosão e o vazamento do material em seu interior. Visto que a pilha possui metais pesados e tóxicos, esse fato constitui um grande perigo à saúde.
Desse modo, o que diferencia basicamente uma pilha alcalina é o fato de possuir uma base como seu eletrólito. Por isso, a pilha alcalina pode ser de:
• Ferro-níquel;
• Prata-zinco;
• Mercúrio-zinco;
• Zinco-manganês, e;
• Níquel-cádmio.