Pilhas e baterias primárias e secundárias
As pilhas e baterias podem ser classificadas em primárias ou secundárias, sendo que as primárias não são recarregáveis e as secundárias são recarregáveis.
Veja os principais exemplos em cada caso:
- Pilhas e baterias primárias: Quando o reagente é todo consumido e a reação de oxirredução que ocorre dentro delas cessa, essas pilhas devem ser descartadas.
- Pilha seca de Leclanché ou pilha ácida:
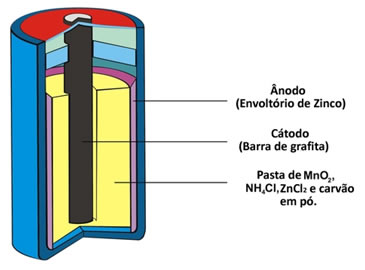
Essa pilha também é chamada de pilha de zinco/dióxido de manganês, pois o seu ânodo (polo negativo, que sofre oxidação) é um invólucro de zinco; enquanto o cátodo (polo positivo, que sofre redução) é formado por um bastão de grafite que fica no centro e está envolvido por uma camada de dióxido de manganês, carvão em pó e uma pasta úmida de cloreto de amônio e cloreto de zinco.
O cilindro de zinco fica separado das outras substâncias químicas por um papel poroso e, conforme mostram as semirreações nos eletrodos abaixo, o zinco transfere elétrons para o manganês por meio da barra de grafite:
Ânodo: Zn (s) → Zn2+(aq) + 2 e-
Cátodo: 2 MnO2(aq) + 2 NH4 1+(aq) + 2e- → 1 Mn2O3 (s) + 2NH3(g) + 1 H2O(l)
Reação Global: Zn (s) + 2 MnO2(aq) + 2 NH41+(aq) → Zn2+(aq) + 1 Mn2O3(s) + 2NH3(g)
- Pilha alcalina:
Essa pilha tem o mesmo esquema da pilha anterior (zinco/dióxido de manganês), porém, com a diferença de que o eletrólito é uma base, e não um ácido. No lugar do cloreto de amônio (que é um sal de caráter ácido) é utilizado o hidróxido de sódio ou de potássio.
As reações que ocorrem nessa pilha são:
Ânodo: Zn + 2 OH → ZnO + H2O + 2e-
Cátodo: 2 MnO2 + H2O + 2e-→ Mn2O3 + 2 OH
Reação global: Zn +2 MnO2→ ZnO + Mn 2O3

- Baterias de lítio:
O ânodo é o lítio, o cátodo é o dióxido de manganês, e o eletrólito é uma solução salina:
Semirreação do Ânodo: Li → Li+ + e−
Semirreação do Cátodo: MnO2 + Li+ + e− → MnO2(Li)
Reação global: Li + MnO2 → MnO2(Li)

- Pilhas e baterias secundárias: Essas pilhas ou baterias podem ser recarregadas por meio da aplicação de uma diferença de potencial (por meio de um gerador, como carregador específico para o aparelho, um alternador ou um dínamo). Com isso, as reações envolvidas no funcionamento desses dispositivos ocorrem no sentido contrário, regenerando os reagentes e permitindo que a bateria seja utilizada novamente.
- Baterias de chumbo usadas em automóveis:
O ânodo dessa bateria é formado por placas de chumbo metálico, e o cátodo é formado por placas de chumbo revestidas de PbO2(s). Essas placas são intercaladas e separadas por papelão ou plástico e mergulhadas em uma solução de ácido sulfúrico concentrado, formando uma série de seis pilhas, com 2V cada e fornecendo um total de diferença de potencial de 12 V.

O chumbo oxida-se, perdendo elétrons, enquanto o dióxido de chumbo reduz-se, ganhando elétrons:
Ânodo: Pb +HSO41-+ H2O ↔ PbSO4 + H3O1+ + 2e-
Cátodo: PbO2 + HSO41-+ 3H3O1+ + 2e-↔ PbSO4 + 5 H2O
Reação global: Pb + PbO2 + 2 HSO41-+ 2 H3O1+↔ 2 PbSO4 + 4 H2O
- Bateria de celular (bateria de íon lítio):
O cátodo dessa bateria é um composto de óxido de lítio e cobalto, e o ânodo é o carbono, sendo que esses dois eletrodos estão separados por um eletrólito não condutor.
O seu funcionamento ocorre pelo movimento dos íons de lítio do ânodo em direção ao cátodo através do eletrólito:
Ânodo: LiyC6 (s) + y Li+(solv) + y e-→Lix+yCoO2(s)
Cátodo: LixCoO2 (s) + y Li+(s) + y e-→Lix+yCoO2(s)
Reação Global: LiyC6(s) → 6 C (s) + y Li+ (solv) + y e-

- Pilha ou bateria de níquel/cádmio:
O ânodo dessa bateria é uma liga de ferro e cádmio, e o cátodo é revestido por uma camada de hidróxido (ou óxido) de níquel III:
Ânodo: 1 Cd(s) + 2 OH-(aq) → 1 Cd(OH)2(s) + 2e-
Cátodo: 2 NiOOH + 4 H2O(?) + 2e- → 2 Ni(OH)2 . H2O(s) +2 OH-(aq)
Reação global: 1 Cd(s) + 2 NiO(OH) + 2 H2O(?) → 1 Cd(OH)2(s) + 2 Ni(OH)2(s)
- Bateria de hidreto metálico/óxido de níquel (NiMH):
Suas atribuições principais são semelhantes à bateria de níquel-cádmio, mas com a modificação de que o ânodo é constituído por uma liga metálica que contém hidrogênio absorvido, formando um hidreto metálico:
Ânodo: MH(s) + OH-(aq) → M(s) + H2O(?) + e-
Cátodo: NiOOH(s) + 2 H2O(?) + e- → Ni(OH)2 . H2O(s) + OH-(aq)
Reação global: 1 Cd(s) + 2 NiO(OH) + 2 H2O(?) → 1 Cd(OH)2(s) + 2 Ni(OH)2(s)

Para mais detalhes a respeito de cada uma dessas pilhas, leia os artigos relacionados mais abaixo.

