Séries Radioativas
O cientista Antoine Henri Becquerel (1852-1908), juntamente ao casal de cientistas Pierre Curie (1859-1906) e Marie Curie (1867-1934), descobriu que o minério de sulfato duplo de potássio e a uralina di-hidratada (K2UO2(SO4)2 . 2 H2O) emitia radiação porque continha em sua constituição o elemento urânio. Chegaram a essa conclusão porque todos os minérios de urânio emitiam radioatividade.
Desse modo, o primeiro elemento químico descoberto como sendo naturalmente radioativo (que realiza emissões espontâneas) foi o urânio.
Entretanto, nesses minérios, o elemento urânio não era a única fonte emissora de radiação. Estudos mais aprofundados mostraram que havia também outros isótopos radioativos nesses minérios, que eram provenientes do decaimento sucessivo do urânio.
Por exemplo, o urânio-238 sofre decaimento, emitindo uma partícula alfa (2 prótons e 2 nêutrons), e forma outro elemento químico, o tório-234. Porém, o tório-234 também é radioativo, porque o seu número atômico é igual a 90, e todos os elementos químicos que possuem número atômico maior que 83 possuem núcleos instáveis que se desintegram.
Assim, o tório-234 emite uma partícula beta, transformando-se no protactínio-234, que é radioativo e também se desintegra. Esse processo continua até que seja formado um núcleo estável de chumbo-206, que não se desintegra:
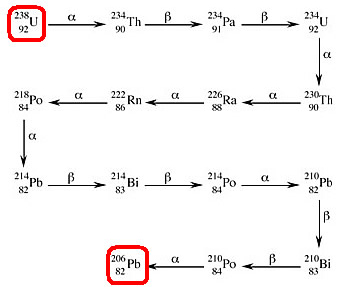
Todos esses elementos radioativos que vieram da desintegração do urânio-238 formam uma série ou família de desintegração radioativa. Com base nesse raciocínio, chegamos à seguinte definição:
Séries radioativas: o conjunto de elementos que têm origem na emissão de partículas alfa e beta, originando, como produto final, um isótopo estável do chumbo.
Todos os elementos radioativos existentes originaram-se de um dos três isótopos a seguir: Urânio-238, Urânio-235 ou Tório-234. Assim, temos a série radioativa do urânio, a série radioativa do actínio (que, na verdade, é a serie do urânio-235, porque quando esse nome foi atribuído a essa série, acreditava-se que o primeiro elemento fosse o actínio) e a série radioativa do tório.
Abaixo é evidenciada a série radioativa do tório:
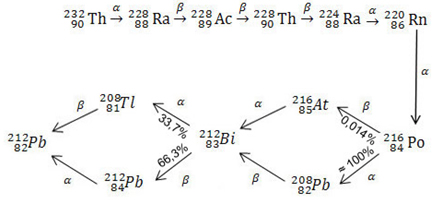
Visto que a emissão de uma partícula alfa diminui o número de massa do elemento em 4 unidades e a emissão de uma partícula beta não altera esse número de massa, é possível descobrir a série à qual determinado elemento radioativo pertence. Basta dividir o seu número de massa por 4 e verificar o resultado:
- Se o resultado der exato, isto é, com resto igual a zero → série do tório;
- Se der resto igual a 2 → série do urânio-238;
- Se der resto igual a 3 → série do urânio-235 (série do actínio).
Exemplo: Descubra à qual série de desintegração radioativa os seguintes elementos pertencem:
- 228Ra:
- 234Th:
- 231Pa:
Resolução:
-
228Ra: 228 ÷ 4 = 57 (exato). Ele faz parte da série do tório.
-
234Th: 234 ÷ 4 = 58 e restam 2. Ele faz parte da série do urânio-238.
-
231Pa: 231 ÷ 4 = 58 e restam 3. Ele faz parte da série do urânio-235 ou série do actínio.

