Título ou Porcentagem em massa de uma solução

O título (τ) de uma solução refere-se à relação entre a massa do soluto (m1) e a massa da solução (m), segundo a expressão abaixo:
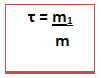
A massa da solução pode ser obtida somando-se a massa do soluto com a massa do solvente (m = m1 + m2).
O título é adimensional, isto é, um número puro e sem unidades. No entanto, se você quiser expressar essa relação em porcentagem em massa (τ%), basta multiplicar o resultado por 100%.

Assim, quando dizemos que determinada solução possui título igual a 0,35, isso significa que para cada unidade de massa da solução há 0,35 unidade de massa de soluto e 0,65 unidade de massa de solvente.
Um exemplo bastante comum do uso da porcentagem no cotidiano ocorre em soluções aquosas, como é o caso do soro fisiológico. O soro fisiológico é uma solução de NaCl (cloreto de sódio – sal de cozinha), que apresenta uma porcentagem em massa de 0,9 %. Isso significa que existem 0,9 grama de NaCl para cada 100 gramas de solução. Assim, podemos concluir que seu título é 0,009.

O exemplo é uma solução líquida, mas o título é usado para exprimir a concentração em qualquer estado de agregação (sólido, líquido ou gasoso).
No caso de soluções em que todos os componentes são gasosos ou são líquidos é possível também calcular o título em volume (τv), por relacionar o volume do soluto com o volume da solução (v), segundo a fórmula:
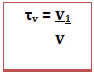
O título em volume também pode ser expresso em porcentagem:
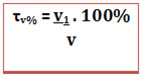
A diferença que existe quando se trabalha com o título em volume é que no título em massa, conforme dito anteriormente, a massa da solução pode ser obtida somando-se a massa do soluto com a massa do solvente. Já aqui isso não é possível, isto é, não podemos somar o volume do soluto com o volume do solvente para obter o volume da solução. Isso ocorre porque as forças intermoleculares existentes entre esses líquidos alteram os seus volumes quando se misturam. Portanto, o volume da solução deve ser medido experimentalmente ou fornecido no exercício.
Por exemplo, a seguir temos a imagem de um frasco de álcool etílico que indica a porcentagem em volume de 96%. Isso quer dizer que em cada 100 unidades de volume da solução, 96 unidades são do álcool e apenas 4 são de água.
.jpg)
Ferramentas Brasil Escola


Últimas notícias
Outras matérias



















