Diferença de potencial de uma pilha

Para entendermos o que é a diferença de potencial de uma pilha, vamos fazer uma analogia com uma cachoeira. A água sempre flui de cima para baixo numa cachoeira, esse é o processo espontâneo, nunca o contrário.
Algo similar ocorre com o fluxo dos elétrons numa pilha, eles sempre vão no sentido do ânodo para o cátodo, isto é, do eletrodo que tem menor potencial de redução para o eletrodo que possui maior potencial de redução (ou do eletrodo que possui maior potencial de oxidação para o eletrodo de menor potencial de oxidação).
Assim, a diferença de potencial (ddp) é a diferença que existe entre os potenciais de cada eletrodo. A sua unidade é o volt (V).
O maior valor para a ddp de uma pilha, que é o valor no início de seu funcionamento, é chamado de força eletromotriz (fem ou E). Ela pode ser medida se colocarmos um aparelho chamado voltímetro entre os dois eletrodos da pilha.
Por exemplo, a pilha de Daniell é formada por um eletrodo de zinco mergulhado numa solução de sulfato de zinco e por um eletrodo de cobre mergulhado numa solução de sulfato de cobre. Se colocarmos um voltímetro no circuito externo dessa pilha, conectado entre os dois eletrodos, veremos que a força eletromotriz dessa pilha é igual a 1,10 V:
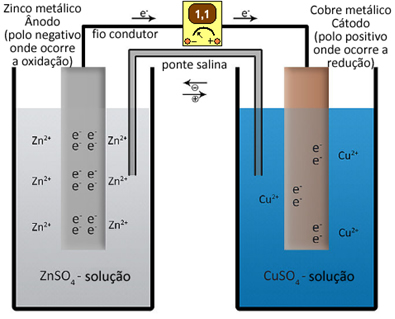
Com o passar do tempo, nota-se que a placa de zinco é corroída e a placa de cobre aumenta de massa, enquanto a solução de sulfato de cobre, que era azul, vai ficando incolor.
Isso comprova que a placa de zinco metálico atua como ânodo ou polo negativo da pilha, porque ele sofre oxidação, perdendo elétrons e se transformando em cátions zinco (Zn2+(aq)), que ficam na solução. É por isso que a placa de zinco vai perdendo massa com o passar do tempo:
Semirreação do ânodo: Zn( s) ↔ Zn2+(aq) + 2 e-
Já a placa de cobre metálico atua como cátodo ou polo positivo da pilha, porque os cátions cobre (Cu2+(aq)) da solução sofrem redução, recebendo os elétrons do zinco, tornando-se cobre metálico (Cu0(s)), que vai se depositando na placa.
Semirreação do cátodo: Cu2+(aq) + 2 e- ↔ Cu( s)
É por isso que a massa da placa de cobre vai aumentando e a solução de sulfato de cobre vai descorando, já que a cor azul se deve à presença dos íons Cu2+.
Isso significa que o zinco tem maior potencial de oxidação que o cobre e, consequentemente, o zinco tem menor potencial de redução que o cobre:
Eoxi Cu2+ < Eoxi Zn 2+
Ered Cu2+ > Ered Zn2+
Numa pilha, sempre a espécie que apresenta o maior potencial de redução sofrerá a redução e, portanto, a outra espécie que possui maior potencial de oxidação, sofrerá a oxidação.
Assim, o sentido do fluxo dos elétrons dependerá de qual metal estará no eletrodo, pois cada metal possui um potencial de redução e de oxidação. Por exemplo, se no lugar do zinco fosse colocada a prata, o cobre não sofreria redução, mas sim oxidação. Nesse caso, o cobre seria o ânodo (polo negativo) e a prata, o cátodo (polo positivo). Isso ocorre porque o cobre tem maior potencial de oxidação do que a prata e a prata tem maior potencial de redução que o cobre.
A força eletromotriz de uma pilha depende de vários fatores, tais como:
- Concentração: No início do funcionamento da pilha, a concentração de íons na solução é maior e, por isso, a capacidade da outra espécie química de doar elétrons é a máxima. Mas, com o tempo, a concentração desses íons vai diminuindo e a ddp diminui gradativamente;
- Temperatura: A elevação da temperatura aumenta a velocidade das reações, provocando variações na ddp da pilha.
Devido a isso, decidiu-se determinar um potencial-padrão (ou normal, em 25°C, pressão de 1atm, e concentração de 1,0 mol/L) que é identificado pelo símbolo E0. A diferença de potencial de uma pilha nessas condições é representada por ΔE0.
O ΔE0 de uma pilha pode então ser calculado pelas seguintes expressões:
ΔE0 = E0red (maior) - E0 red (menor)
ΔE0 = E0oxi (maior) - E0 oxi (menor)
A IUPAC recomenda que se trabalhe preferencialmente com os potenciais de redução dos eletrodos, em vez dos potenciais de oxidação.
No caso da pilha de Daniell, o potencial de redução do zinco é – 0,76 e o potencial de redução do cobre é + 0,34. Assim, o valor da ddp dessa pilha será:
Zn2+(aq) + 2 e- ↔ Zn( s) Ered = - 0,76 V
Cu2+(aq) + 2 e- ↔ Cu( s) Ered = + 0,34 V
ΔE0 = E0red (maior) - E0 red (menor)
ΔE0 = Ered Cu2+ - Ered Zn2+
ΔE0 = + 0,34 – (- 0,76)
ΔE0 = + 1,10 V
Esse é exatamente o valor apontado no voltímetro.
Os potenciais de redução e de oxidação de um elemento são numericamente iguais, apenas com o sinal oposto. Por exemplo, o potencial de redução do cobre, como já dito, é + 0,34, e seu potencial de oxidação é igual a – 0,34.
O ΔE0 de uma pilha será maior quanto maior for o potencial de redução do cátodo e maior o potencial de oxidação do ânodo.
Se compararmos a pilha de zinco-cobre (de Daniell) com a de cobre-prata, veremos que o ΔE0 da primeira pilha é maior, porque a diferença de potencial entre os eletrodos de zinco e de cobre é maior (1,10V) do que entre os eletrodos de cobre e de prata (0,46V):
Ag+(aq) + e- ↔ Ag( s) Ered = + 0,80 V
Cu2+(aq) + 2 e- ↔ Cu( s) Ered = + 0,34 V
ΔE0 = E0red (maior) - E0 red (menor)
ΔE0 = Ered Ag+- Ered Cu2+
ΔE0 = + 0,80 – 0,34
ΔE0 = + 0,46 V



