Balanceamento de reações de oxirredução
Todo balanceamento de reações de oxirredução se baseia no seguinte princípio:
O número de elétrons cedidos deve ser igual ao número de elétrons doados.
Por exemplo, considere a reação simples abaixo, que foi citada na imagem:
Al + Cu2+ → Al3+ + Cu
Nota-se, neste caso, que apesar dos coeficientes serem iguais (1) a reação não está balanceada, pois a quantidade de elétrons perdidos pelo alumínio foi de três (Al3+), enquanto que a de elétrons cedidos pelo cobre foi de dois (Cu2+). Assim, é necessário balancear essa reação.
No caso de reações de oxirredução simples como esta, basta igualar o número de elétrons seguindo o seguinte raciocínio:
1 átomo de Al perde 3 elétrons → 2 átomos de Al perdem 6 elétrons
1 átomo de Cu ganha 2 elétrons → 3 átomos de Cu ganham 6 elétrons
Assim, baseando neste raciocínio, os coeficientes dessas espécies químicas são trocados:
2Al + 3Cu2+ → Al3+ + Cu
Assim, é possível determinar os coeficientes das outras espécies, obtendo a equação balanceada:
2Al + 3Cu2+ → 2Al3+ + 3Cu
No entanto, em reações mais complexas, pode-se seguir o método das variações globais (?). Este é um método simples, que segue os seguintes passos:

Exemplo: KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
1º Passo:
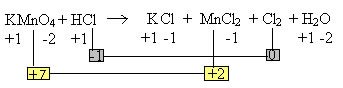
Nox (Mn)= 5
Nox (Cl) = 1
2º Passo:
KMnO4 + HCl → KCl + 2MnCl2 + 5Cl2 + H2O
3º Passo:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O