Oxirredução
Oxirredução é uma reação que envolve a transferência de elétrons entre substâncias, havendo uma espécie que perde elétrons (oxidação) e outra que ganha (redução). Reações de oxirredução também são chamadas de reações redox. É como uma dança química em que os elétrons mudam de parceiros, gerando energia, transformando materiais ou até mesmo mantendo a vida, como é o caso da fotossíntese das plantas. Logo, entender essas reações nos ajuda a compreender diversos fenômenos, que vão desde processos industriais, como a produção de metais, até questões ambientais, como a ferrugem ou a poluição.
Leia também: Por que os metais enferrujam?
Resumo sobre oxirredução
- Oxirredução é um processo químico que envolve a transferência de elétrons entre substâncias. Nesse processo, ocorrem duas reações simultâneas: oxidação e redução.
- Oxidação é a perda de elétrons por uma espécie química.
- Redução é o ganho de elétrons por outra espécie química.
- O agente redutor é a espécie que perde elétrons, sofre oxidação e provoca a redução de outra.
- O agente oxidante é a espécie que ganha elétrons, sofre redução e causa a oxidação de outra.
- Para identificar uma reação de oxirredução, verifica-se a variação do número de oxidação (NOX) dos elementos.
- São tipos de oxirredução: corrosão, combustão, desproporcionamento, pilhas galvânicas e eletrólise.
- No cotidiano está presente em pilhas, baterias, fotossíntese, ferrugem, clareamento de roupas, corrosão de metais e branqueamento de cabelo.
O que é oxirredução?
Oxirredução é um processo químico que envolve a transferência simultânea de elétrons entre substâncias, em que ocorrem duas reações interligadas: a oxidação e a redução.
Processo de oxirredução
No processo de oxirredução, temos a oxidação, cuja característica é a perda de elétrons por uma espécie química, enquanto na redução, uma espécie química ganha elétrons. Logo, por se tratar de um processo simultâneo, sempre que algo é oxidado, outro é reduzido.
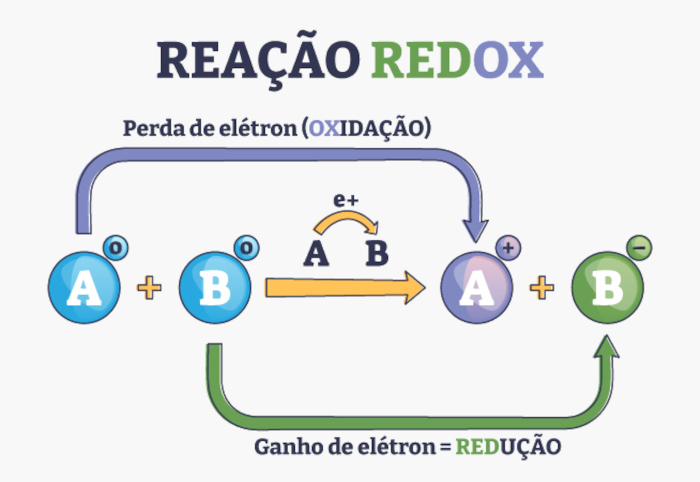
Diante disso, é importante destacar alguns pontos:
- A espécie química que perde elétrons, isto é, sofre oxidação, é denominada agente redutor, pois provoca a redução do NOX (número de oxidação) de outra substância.
- Por outro lado, a espécie que ganha elétrons, ou seja, sofre redução, é chamada de agente oxidante, porquanto gera a oxidação (um aumento do NOX) de outra espécie química.
Veja também: Qual é a regra do número de oxidação (NOX)?
Como identificar uma reação de oxirredução?
Para identificar uma reação de oxirredução, é necessário escrever a equação química da reação e verificar se houve transferência de elétrons entre as substâncias envolvidas. Nesse sentido, é preciso determinar o NOX de cada elemento químico envolvido no processo. Caso haja variação do NOX entre as espécies, então houve transferência de elétrons, logo se trata de uma reação de oxirredução.
Vejamos o clássico exemplo da reação entre o cobre e o zinco:
Zn (s) + Cu2+ (aq) → Zn2+ (aq) + Cu (s)
Aqui, pressupõe-se que você já conheça as regras do NOX. Por isso, para esse exemplo, vamos citar somente o necessário para a resolução:
- Substâncias simples têm NOX igual a zero.
- O NOX de íons monoatômicos é a sua própria carga.
Portanto, ao determinar o NOX de cada elemento participante, é possível identificar aquele que sofreu oxidação e qual teve redução, conforme o esquema abaixo:
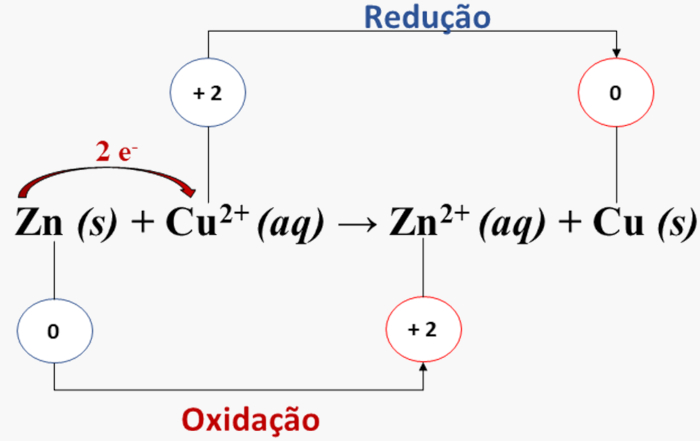
Nesse caso temos a seguinte relação:
Zn (s) → Zn2+ (aq): NOX aumentou de 0 para + 2, logo o Zn (s) sofreu oxidação.
Cu2+ (aq) → Cu (s): NOX reduziu de + 2 para 0, logo o Cu2+ (aq) sofreu redução.
Em outras palavras, ao analisar uma reação, pergunte-se:
- Há ganho ou perda de elétrons?
- Alguém está sendo oxidado ou reduzido? Se a resposta for “sim”, você está lidando com uma reação de oxirredução.
Balanceamento por oxirredução
Para fazer o balanceamento de uma equação química por oxirredução, em primeiro lugar determinam-se os números de oxidação de cada elemento antes e depois da reação. Veja um exemplo de uma equação desbalanceada:
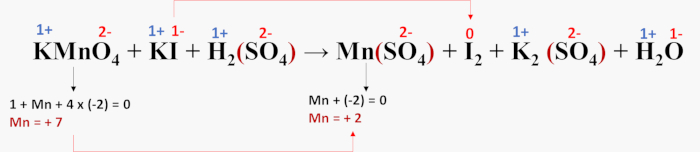
KMnO4 + KI + H2SO4 → MnSO4 + I2 + K2SO4 + H2O
- Passo 1: início do balanceamento e determinação do NOX de cada elemento participante.
- Passo 2: identificam-se as espécies químicas que sofrem oxidação e redução.
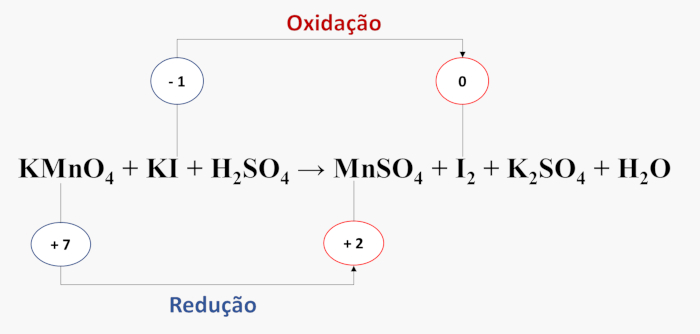
- Passo 3: calcula-se a variação do número de elétrons transferidos em cada processo.
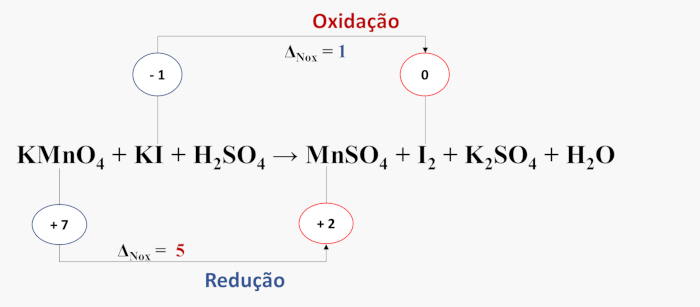
- Passo 4: ajustam-se os coeficientes das substâncias de forma que o total de elétrons perdidos na oxidação seja igual ao total de elétrons ganhos na redução. Para isso, obtém-se a variação de NOX total de cada substância, multiplicando-se cada Δ pelos respectivos números de átomos de cada elemento que oxidou e reduziu.
A multiplicação é feita, preferencialmente, seguindo o lado da equação que possui o maior número átomos de cada elemento. No caso do iodo, a molécula de I2 possui dois átomos, portanto será Δ x 2. O NOX total da espécie que oxidou será o coeficiente estequiométrico da espécie que reduziu e vice-versa, conforme é mostrado a seguir:
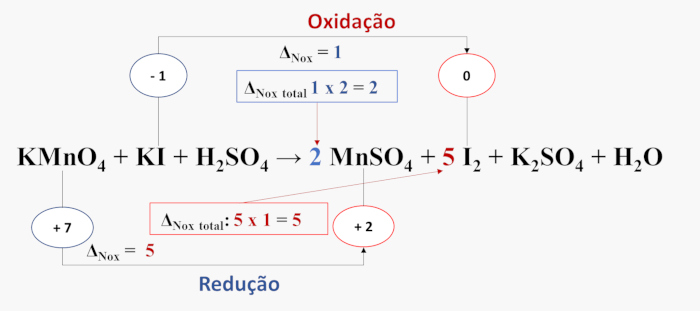
- Passo 5: realiza-se o balanceamento completo, por tentativa, ajustando os átomos de hidrogênio, oxigênio e dos demais elementos, quando necessário, utilizando moléculas de água (H2O), íons hidrogênio (H⁺) ou hidróxidos (OH⁻), dependendo do meio onde a reação ocorre (ácido ou básico).
2 KMnO4 + 10 KI + 8 H2SO4 → 2 MnSO4 + 5 I2 + 6 K2SO4 + 8 H2O
O resultado final é uma equação balanceada, que respeita tanto a conservação de massa quanto de carga, garantindo que a reação esteja corretamente representada.
→ Videoaula sobre balanceamento por oxirredução
Tipos de oxirredução
Existem vários contextos diferentes em nosso dia a dia em que ocorre uma reação de transferência de elétrons entre substâncias, portanto existem diferentes tipos de oxirredução.
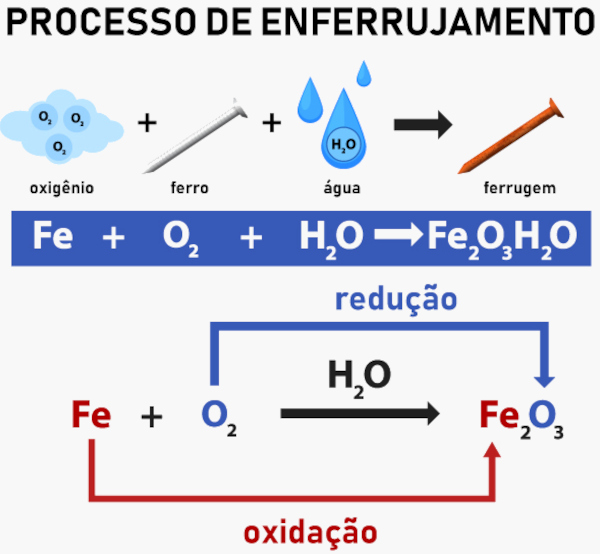
→ Corrosão
É a oxirredução responsável pela degradação de materiais metálicos, como o ferro. Nesse processo, o ferro é oxidado (perde elétrons) em presença de água e oxigênio, formando ferrugem (óxido de ferro).
→ Combustão
Nesse caso, um combustível, como hidrocarbonetos, reage com o oxigênio, liberando energia na forma de calor e luz. O metano (CH4), por exemplo, ao sofrer combustão, é oxidado, e o O2 é reduzido.
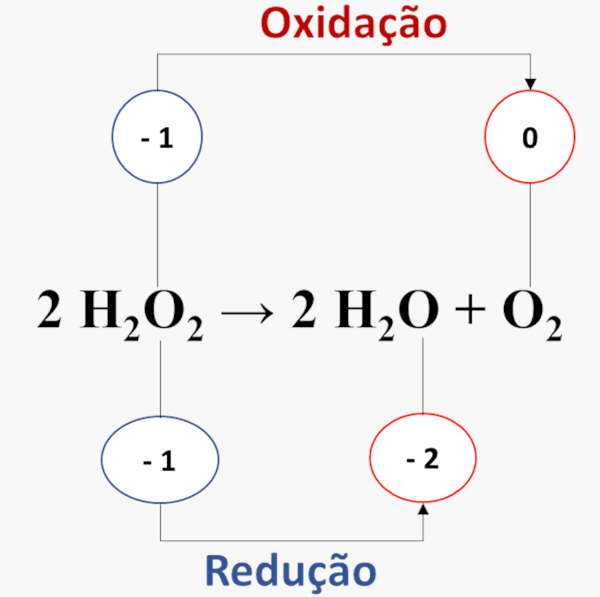
→ Reações de desproporcionamento ou auto-oxirredução
Ocorre quando um único elemento sofre oxidação e redução simultaneamente. Por exemplo, o peróxido de hidrogênio (H2O2) se decompõe, com o oxigênio sendo oxidado e reduzido ao mesmo tempo:
→ Pilhas galvânicas
Configuram-se em reações espontâneas de oxirredução que geram energia elétrica. Um exemplo é a pilha de Daniell, cuja reação foi demonstrada no início deste artigo por:
Zn (s) + Cu2+ (aq) → Zn2+ (aq) + Cu (s)
→ Eletrólise
São reações não espontâneas de oxirredução induzidas por uma corrente elétrica externa, como é o caso da eletrólise da água:
2 H2O + corrente elétrica → 2 H2 + O2
→ Outros processos de oxirredução
Oxirreduções também ocorrem em sistemas biológicos, como a respiração celular, processo no qual a glicose é oxidada e o oxigênio é reduzido para produzir energia. Além disso, essas reações estão presentes em reações de decomposição, tratamento de metais e síntese química.
Oxirredução no cotidiano
No cotidiano a oxirredução está presente em processos variados:
- As pilhas e baterias utilizadas em celulares, controles remotos e outros dispositivos funcionam com base em reações de oxirredução, pois são os elétrons transferidos nas reações químicas que geram energia elétrica.
- Nas plantas, o dióxido de carbono é reduzido e a água é oxidada, produzindo glicose e oxigênio.
- O ferro reage com oxigênio e água, formando óxido de ferro (ferrugem).
- Em uma pilha alcalina, o zinco (Zn) é oxidado, liberando elétrons, enquanto o dióxido de manganês (MnO2) é reduzido.
- Compostos fenólicos presentes em frutas, como maçãs, reagem com o oxigênio do ar, oxidando-se e escurecendo a superfície.
- A queima de gás de cozinha envolve a oxidação do carbono e do hidrogênio, liberando energia.
- O hipoclorito de sódio (NaClO) oxida os pigmentos de manchas de roupas, quebrando suas moléculas e removendo a cor.
- Ao colocar zinco (Zn) em ácido clorídrico (HCl), o zinco é oxidado, e o hidrogênio (H⁺) é reduzido, liberando gás hidrogênio.
- O peróxido de hidrogênio (H2O2) oxida os pigmentos do cabelo, clareando-os.
Saiba mais: Qual é a função da eletrólise?
Exercícios resolvidos sobre oxirredução
1. (Unimontes) Em meio ácido, os íons dicromato reagem com o iodeto conforme a reação a seguir:

Com base na reação, é CORRETO afirmar:
a) O íon H+ atua como agente redutor.
b) O íon dicromato atua como agente oxidante.
c) O íon iodeto é reduzido a iodo de acordo com a reação.
d) O número de oxidação do cromo permanece inalterado.
Gabarito: b.
Agente redutor é a espécie que oxida. Agente oxidante é a espécie que reduz. Posto isso, vamos analisar as alternativas:
a) Falso. O íon H⁺ não muda seu número de oxidação durante a reação. Ele apenas atua como fonte de prótons para equilibrar a carga e o meio ácido, mas não participa diretamente da transferência de elétrons. Portanto, não é um agente redutor.
b) Correto. O íon dicromato sofre redução, pois o cromo muda seu NOX de +6 no Cr2O72− para +3 no Cr3+. Além disso, ele ganha elétrons, logo é o agente oxidante.
c) Falso. O íon iodeto I− é oxidado, pois seu NOX aumenta de -1 no I- para 0 no I2, ou seja, ele perde elétrons, portanto sofre oxidação, e não redução.
d) Falso. Conforme a alternativa “b”, o NOX do dicromato foi reduzido.
2. (FAG) Uma bateria muito comum utilizada na medicina é o marcapasso, que é colocado sob a pele de pessoas com problemas cardíacos, com a finalidade de regular as batidas do coração. A reação responsável pela produção de corrente elétrica pode ser representada pela equação:
HgO(s) + Zn(s) + H2O(l) → Zn(OH)2(aq) + Hg(l)
A partir dessas informações, assinale a afirmativa INCORRETA.
a) O mercúrio do HgO sofre uma redução.
b) O metal zinco atua como agente oxidante.
c) A variação do número de oxidação do mercúrio na reação é de + 2 para 0.
d) O zinco aumenta o seu número de oxidação na reação.
e) Nenhuma das alternativas anteriores.
Gabarito: b.
Primeiro vamos identificar quem oxidou ou reduziu a partir dos números de oxidação:

Nesse caso, temos as seguintes premissas:
- O mercúrio sofreu redução, pois teve seu NOX reduzido, portanto é o agente oxidante;
- O zinco sofreu oxidação, pois o seu NOX aumentou, logo é o agente redutor.
A partir disso, podemos inferir que o item INCORRETO é a alternativa “b”.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. A representação das reações redox. In: Princípios de Química: Questionando A Vida Moderna e o Meio Ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 537–544.
L. BROWN, T. et al. Eletroquímica. In: Química: A Ciência Central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 896–947.
REIS, M. Pilhas e Baterias. In: Química. 1. ed. São Paulo: Editora Ática, 2013. v. 2p. 264–289.


