Cálculo da Velocidade Média de uma Reação

A velocidade média de uma reação (Vm) pode ser medida por meio da variação da concentração dos reagentes ou da variação da concentração dos produtos em relação ao tempo transcorrido de reação, conforme a fórmula a seguir:

Visto que se considera a variação da concentração e do tempo, é necessário diminuir os valores finais pelos iniciais daquele intervalo da reação. Isso permite que esse cálculo da velocidade média seja feito em qualquer intervalo de tempo do processo:

Se for considerada a variação da concentração dos produtos, a fórmula será:

Já no caso da variação da concentração dos reagentes, teremos que adicionar um sinal negativo na fórmula, pois como os reagentes são consumidos durante o processo, a sua concentração final será menor que a inicial e o resultado daria negativo, assim, temos:
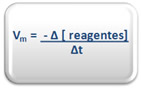
A unidade da velocidade média será dada de acordo com as unidades da concentração e do tempo. Por exemplo, se a concentração for dada em mol/L e o tempo em segundos, a unidade de Vm será mol. L-1. s-1. No entanto, as quantidades de reagentes e produtos também podem ser expressas em termos de massa, volume – principalmente no caso de gases –, número de mol, etc. Já o tempo também pode ser dado em minutos ou horas, dependendo da velocidade com a qual se processa a reação.
Até agora explicamos quais são as fórmulas para se calcular separadamente as velocidades médias de consumo do reagente e de formação do produto, porém, como conseguimos a velocidade média global da reação?
Basta dividir cada valor da velocidade pelo coeficiente da respectiva substância na equação química que representa a reação. De forma geral:

Para entender como se aplica esse conceito, vejamos o exemplo de uma reação que ocorre em um balão com 10 mol do gás ozônio (O3). Suas moléculas colidem umas com as outras, formando moléculas de oxigênio (O2), conforme a equação química a seguir:
2O3→ 3O2
Depois de 1 minuto restam apenas 4 mol de ozônio, o que significa claramente que 6 mol reagiram. Assim, a velocidade média de decomposição do O3 foi de 6 mol. L-1. min-1, como mostrado a seguir:
Vm = - ? [ reagentes]
?t
Vm = - ? [ final - inicial]
?t
Vm = - ? [ O3]
?t
Vm = - [4-10 ] mol/L
1 min
Vm = 6 mol/L
1 min
Vm de decomposição de O3= 6 mol. L-1. min-1
Isso significa que, durante 1 minuto, seis mol de O3 reagiram em cada litro do sistema.
Mas se fizéssemos esse cálculo em relação ao produto (O2), a velocidade média da reação de sua formação seria de 9 mol. L-1. min-1:
2O3→ 3O2
2 mol ------ 3 mol
6 mol ------ x
x = 9 mol de O2 formados
Vm = ? [ produto]
?t
Vm = ? [ final - inicial]
?t
Vm = ? [ O2]
?t
Vm = [9 - 0 ] mol/L
1 min
Vm = 9 mol/L
1 min
Vm de formação de O2 = 9 mol. L-1. min-1
Se quisermos descobrir também a velocidade global da reação, basta, conforme já dito, dividir cada velocidade pelo seu respectivo coeficiente. Veja como isso é feito abaixo:
2O3→ 3O2
Vm da reação= 6 mol. L-1. min-1 = 3 mol. L-1. min-1
2
Ou
Vm da reação= 9 mol. L-1. min-1 = 3 mol. L-1. min-1
3
Ferramentas Brasil Escola

Artigos Relacionados

Últimas notícias
Outras matérias


















