Cinética química
Cinética química é uma área de estudo da Química, dentro da Físico-Química, que estuda a velocidade de ocorrência das reações químicas. Na cinética não há só o interesse em mensurar as velocidades das reações, mas também interpretá-las e entender os mecanismos de controle de velocidade das reações.
A cinética química possui modelos para explicar a ocorrência de reações em nível atômico, a chamada teoria das colisões. Os modelos cinéticos permitem cálculos das velocidades médias das reações químicas, bem como entender os fatores que podem alterar a velocidade das reações, como a concentração dos reagentes, a temperatura, a superfície de contato dos reagentes e a presença de catalisadores.
Leia também: Afinal, o que são as reações químicas?
Resumo sobre cinética química
-
A cinética química é uma área da Físico-Química empenhada em estudar a velocidade dos processos químicos, assim como forma de controlar as velocidades.
-
A velocidade média de uma reação química é a razão entre a variação da quantidade de reagente ou produto e o tempo total de reação.
-
As leis de velocidade são feitas a partir da velocidade inicial de consumo de reagente.
-
A cinética busca, por meio da teoria das colisões, explicar as condições necessárias para a ocorrência de uma reação química em nível atômico ou molecular.
-
Existem fatores capazes de alterar a velocidade da reação química, como a concentração, a temperatura, a superfície de contato e o catalisador.
-
Catalisadores são substâncias químicas que diminuem a energia de ativação da reação química ao estabelecer uma nova rota reacional no meio. No fim, tais substsâncias não são quimicamente consumidas.
-
A cinética química pode ser aplicada em diversos setores, como na indústria farmacêutica, no desenvolvimento de eletrodomésticos e de sistemas de segurança.
O que é cinética química?
A cinética química é a área da Química, mais especificadamente da Físico-Química, que estuda a velocidade de ocorrência das reações químicas. Na cinética química não há apenas o interesse em mensurar a velocidade de uma reação, mas também interpretá-la, ou seja, entender os mecanismos específicos que possam controlar essa velocidade, seja para aumentá-la, seja para diminui-la.
O que se estuda na cinética química?
A cinética química estuda a velocidade das reações químicas. Nisso, ela está empenhada em desenvolver modelos experimentais e teóricos que justifiquem as diferenças de velocidade entre as reações químicas, ou seja, o que faz com que um processo se desenvolva mais rapidamente que o outro, quais são as variáveis de controle que vão influenciar na velocidade de uma reação.
Além disso, a cinética química está focada em determinar, quantitativamente, a taxa de produção ou de consumo de determinado reagente ou produto em um processo químico. Ou seja, assim como a Física, em cinemática, mensura o deslocamento de um corpo em um dado intervalo de tempo, a cinética química mensura a variação de massa (ou mols) de determinada substância em dado intervalo de tempo.
Principais assuntos da cinética química
→ Velocidade das reações químicas
Quando pensamos em velocidade, pensamos na variação de determinada propriedade em determinado intervalo de tempo. Quando um carro se desloca de um ponto a outro, sua velocidade instantânea pode ser verificada ao se olhar o velocímetro, enquanto sua velocidade média naquele percurso é determinada pela razão entre a distância percorrida e o tempo gasto para realizar o trajeto.
Em Química, no campo das reações, a avaliação é semelhante: a velocidade média de uma reação é a razão entre a variação de uma propriedade quantitativa da substância química (seja concentração, massa ou mols) e o tempo de reação observado. Essa velocidade média (vm) pode ser determinada tanto em relação ao consumo de reagentes quanto em relação à formação de produtos.
\(v_{m} = -\frac{ \Delta R}{\Delta t} \), se em relação aos reagentes.
\(v_{m} = -\frac{\Delta P}{\Delta t} \), se em relação aos produtos.
Como a variação da quantidade dos reagentes é negativa (porquanto a quantidade final de reagentes é sempre menor que a inicial), utiliza-se um sinal negativo antes da equação de modo que a velocidade média fique positiva.
Contudo, a velocidade de consumo de um reagente ou de formação de um produto pode variar a depender do coeficiente estequiométrico da reação. Por exemplo, tem-se a seguinte reação:
2 N2O5 → 4 NO2 + O2
Nesse caso, o NO2 possui a maior variação de quantidade em relação ao tempo, uma vez que seu coeficiente estequiométrico é igual a 4. Para corrigir essas variações, a cinética química também estabelece o conceito de velocidade média única, em que os valores das velocidades médias de cada participante são divididos por seus coeficientes estequiométricos. Dessa forma, haverá um único valor de velocidade média para toda a reação:
\(v_{m (\text{Única})} = -\frac{ v_{\text{N}_{2}\text{O}_{5}}}{2} = \frac{v_{\text{NO}_{2}}}{4} = \frac{v_{\text{O}_{2}}}{1} \)
Mais uma vez a velocidade do reagente (N2O5) recebe o sinal negativo de modo que a velocidade não fique com valor negativo.
◦ Lei da velocidade da reação
Uma das formas mais interessantes de se medir a tendência de velocidade de uma reação química se dá pela medida da velocidade inicial da reação. Esse é um ponto importante, visto que não há produtos e estes podem afetar a velocidade da reação química. Eis, novamente, a reação:
2 N2O5 → 4 NO2 + O2
Percebe-se, experimentalmente, que a velocidade inicial é proporcional à concentração do reagente (ou seja, quanto mais reagente, maior a velocidade inicial).
\(\text{velocidade} \propto [N_2O_5]_{\text{inicial}} \)
A proporcionalidade pode se tornar uma igualdade se for usada uma constante (k) de proporcionalidade:
\(\text{velocidade} = k \times [N_2O_5]_{\text{inicial}} \)
O mais importante dessa avaliação é que, conforme a reação se desenvolve e a concentração de N2O5 cai, a velocidade também cai, ou seja, a equação é válida para todos os instantes da reação. Contudo, cada reação possui sua própria lei de velocidade, na qual a dependência com a concentração pode ser diferente. No caso da seguinte reação:
2 NO2 → 2 NO + O2
A velocidade de consumo de NO2 possui uma relação quadrática com sua concentração, sendo igual a:
\(\text{velocidade} = k \times [NO_2]^2 \)
Já a amônia, ao se decompor:
2 NH3 → N2 + 3 H2
Desenvolve uma velocidade constante, não dependendo da sua concentração, e, por isso, temos a seguinte velocidade igual apenas à constante k:
\(\text{velocidade} = k \times [NH_3]^0 \therefore \text{velocidade} = k \)
Porém, independentemente da reação, percebemos que a lei da velocidade da reação sempre possui a seguinte estrutura:
\(\text{velocidade} = k \times [R_1]^a \times [R_2]^b \times \dots \times [R_n]^z \)
Onde [R] é igual à concentração dos reagentes. Os parâmetros a, b... z são conhecidos como ordens de reação.
Uma reação em que a ordem é igual a 1 é chamada de reação de primeira ordem. Uma reação em que a ordem é igual a 2 é chamada de reação de seguda ordem. O somatório total das ordens (a + b +...+ z) é chamada de ordem global da reação.
Embora a lei de velocidade seja determinada experimentalmente, assim como as ordens, há casos em que a mesma pode ser descrita de forma direta.
-
Reações elementares: São reações que ocorrem em uma única etapa. Dessa forma, os coeficientes estequiométricos são numericamente iguais às ordens. É o caso da reação de decomposição do NO2, já exposta aqui anteriormente.
2 NO2 → 2 NO + O2
\(\text{velocidade} = k \times [NO_2]_2 \)
-
Etapa lenta de uma reação química: Em uma reação que ocorre em mais de uma etapa, a etapa lenta sempre será a determinante para a velocidade da reação química. Dessa forma, a lei de velocidade será em relação a essa etapa, e as ordens serão numericamente iguais às ordens da reação lenta. Tem-se a reação:
(CH3)3CBr + OH− → (CH3)3COH + Br−
Ela se desenvolve em duas etapas:
(CH3)3CBr → (CH3)3C+ + Br− (lenta)
(CH3)3C+ + OH− → (CH3)3COH (rápida)
Assim sendo, a lei de velocidade é igual a:
\(\text{velocidade} = k \times [(CH_3)_3CBr] \)
Para saber mais detalhe sobre a velocidade das reações químicas, clique aqui.
→ Teoria das colisões
A teoria das colisões é um modelo molecular para explicar a forma como ocorrem as reações químicas. Assim sendo, vamos enumerar alguns fatores necessários para o desenvolvimento sucessivo de um processo químico.
A primeira coisa que devemos entender é que, para a ocorrência de uma reação química, deve haver contato e afinidade entre os reagentes. Por exemplo, o monóxido de carbono, CO, e a água, H2O, são dois compostos que, mesmo em contato, não irão reagir, visto que a natureza química dessas espécies impede qualquer afinidade. Pois bem, dentro do modelo da teoria das colisões devemos entender que os átomos e as moléculas são como bolas de bilhar defeituosas, ou seja, ao colidirem em baixa velocidade, simplesmente ricocheteiam, mas ao colidirem em alta velocidade, despedaçam-se.
Dentro dessa ideia é possível enumerar o primeiro fator importante para a teoria das colisões: a energia cinética das partículas. Assim, existe uma energia cinética mínima que fará com que a colisão entre as partículas seja suficientemente energética para despedaçar as bolas de bilhar. Essa energia cinética mínima é conhecida como energia de ativação, ou seja, a mínima energia cinética necessária que os participantes devem ter para que a sua colisão permita que a reação química ocorra.
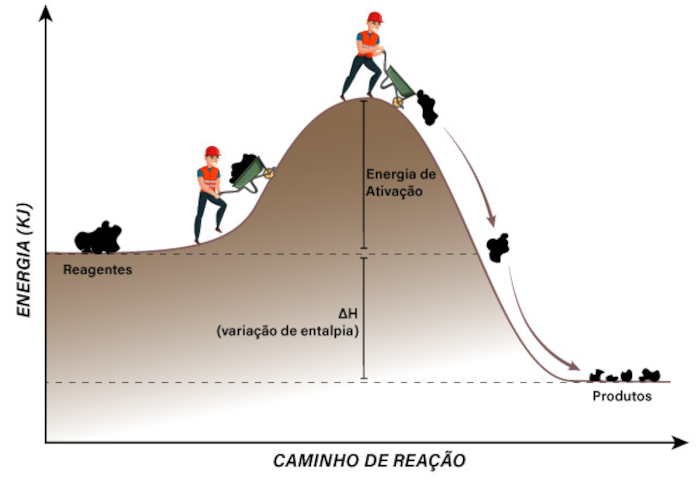
Porém, além da dependência energética, devemos refinar o modelo para que ele se aproxime do que é observado experimentalmente. Uma bola de bilhar é um objeto esférico, simétrico, ou seja, colidir pela face frontal, lateral ou traseira não faz diferença se o objetivo é despedaçá-la. Contudo, isso não pode ser aplicado em moléculas, uma vez que as mesmas podem apresentar elementos distintos. Imagine a reação em que um átomo de cloro, Cl, busca reagir com uma molécula de HI, resultando assim em um átomo de I e uma molécula de HCl. Caso o átomo de cloro colida com o lado da molécula em que se encontra o iodo, a reação não ocorrerá, visto que, para produzir o HCl, há necessidade da colisão entre o Cl e o H.
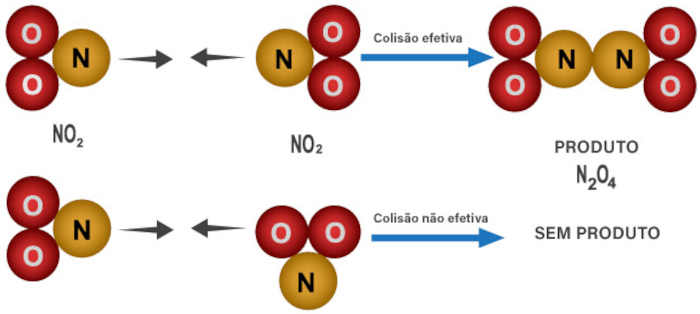
Com isso, podemos entender que existe uma exigência espacial nessa colisão, que quer dizer que as colisões também exigem orientação correta. Assim, entendemos que a teoria das colisões apresenta que não basta haver contato e afinidade entre os reagentes, mas também uma energia cinética mínima para colisão (a energia de ativação), bem como uma orientação espacial adequada para tal colisão. Só com a soma desses fatores é que uma reação química ocorre.
→ Fatores que alteram a velocidade das reações químicas
A velocidade das reações químicas pode sofrer influência de alguns fatores.
◦ Concentração dos reagentes
Segundo a teoria das colisões, quanto maior a frequência de colisão entre os participantes, maior a probabilidade de ocorrência da reação química. Dessa forma, quanto maior for a concentração dos participantes, maior a velocidade das reações químicas, uma vez que a frequência de colisões por intervalo de tempo aumenta, propiciando um maior número de colisões efetivas (colisões que desencadeiem uma reação química de fato).
Em sistemas gasosos, um sistema pode ser pressurizado por ação de um êmbolo, o que acarreta uma diminuição do volume total. Isso gera maior concentração de participantes gasosos (vale lembrar que a concentração refere-se à quantidade por unidade de volume). Dessa forma, sistemas gasosos que sofram diminuição de volume possuem também maior frequência de colisões e, assim, maior velocidade de reação química.
◦ Temperatura
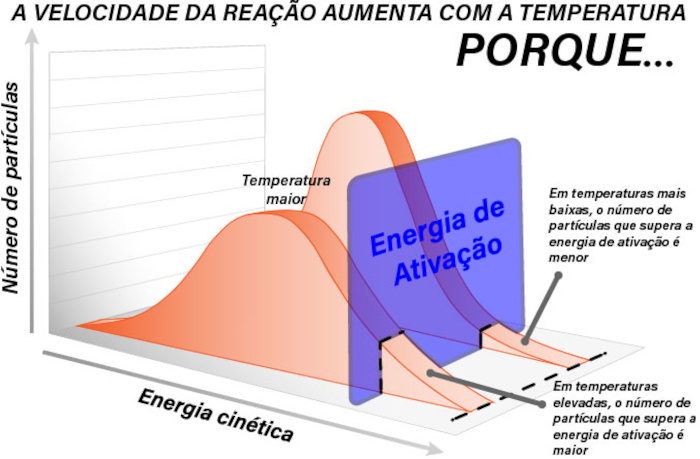
A temperatura é um fator de extrema importância para o controle da velocidade da reação química. Vale lembrar que a temperatura é uma medida direta da energia cinética da partícula. A energia cinética (Ec) é dada por:
\(E_{c} = \frac{m \cdot v^2}{2} \)
Assim fazendo com que estas sofram uma alteração diretamente quadrática na velocidade e movimentando-se com muito mais velocidade. Essa maior velocidade torna as colisões mais energéticas e frequentes, aumentando não só a frequência das colisões, mas a probabilidade de se superar a energia de ativação. Dessa forma, um aumento na temperatura gera um aumento na velocidade da reação e, de forma contrária, a queda da temperatura diminui a velocidade das reações químicas.
◦ Superfície de contato
A superfície de contato tem relação com a quantidade de substância disponível para reagir em um mesmo intervalo de tempo. Quanto mais participantes estiverem em contato, maior a velocidade da reação química. Um fácil exemplo para visualizar a questão da superfície de contato tem a ver com a dissolução de comprimidos efervescentes.
Quando colocamos um comprimido efervescente inteiro para dissolver, a dissolução é mais lenta se compararmos com o mesmo comprimido sendo dissolvido após ser macerado. Quando trituramos o comprimido, mais partes do mesmo estão em contato com a água, ou seja, maior o contato entre água e comprimido. Com o comprimido inteiro, a dissolução da parte interna só se inicia após dissolução da parte externa, o que atrasa o processo.
◦ Catalisadores
Catalisadores são substâncias químicas que, quando disponíveis no meio reacional, apresentam uma rota reacional alternativa, de menor energia de ativação. Assim sendo, aceleram o processo químico. O funcionamento é relativamente simples: quando disponível, o catalisador se liga ao reagente, fazendo com que a reação se desenvolva de forma diferente (com menor energia de ativação). Porém, o mais interessante é que ao final o catalisador se desprende e é então regenerado. Isso quer dizer que os catalisadores não são quimicamente consumidos em uma reação química, o que explica o grande interesse por esses compostos.
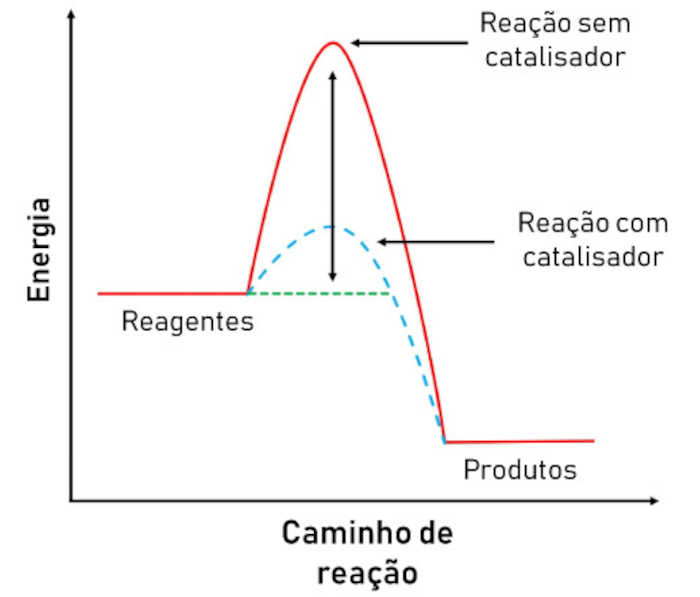
Os catalisadores podem estar na mesma fase do reagente, sendo conhecidos como catalisadores homogêneos. Já os catalisadores que estão em fase distinta do reagente são chamados de catalisadores heterogêneos. Na biologia, as enzimas funcionam como catalisadores, acelerando as reações metabólicas.
Para saber mais detalhes sobre os fatores que alteram a velocidade das reações químicas, clique aqui.
Aplicações da cinética química no cotidiano
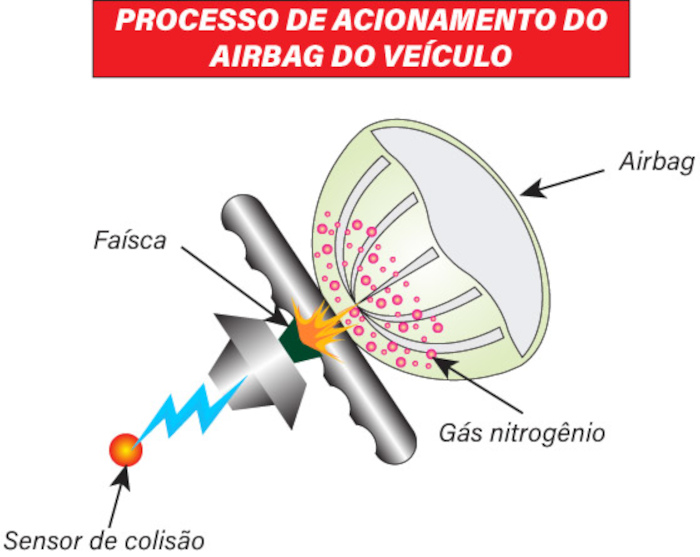
Muitos são os pontos em que a cinética química é de grande importância para nós. Por exemplo, os airbags são dispositivos de segurança obrigatórios nos carros atuais. Consistem em bolsas que inflam em fração de segundos, logo após a percepção da colisão do veículo, que, por meio de um sensor, desenvolve uma faísca. Tal faísca é a energia de ativação para a decomposição da azida de sódio:
2 NaN3 → 2 Na + 3 N2
A reação deve se desenvolver muito rapidamente e, por isso, não é qualquer reagente que deve ser escolhido para tal fim.
Ainda no campo dos veículos automotores, existe um catalisador dentro do sistema de exaustão. A função do catalisador é permitir a reação de conversão de gases nocivos que possam ser produzidos na câmara de combustão do motor, como o CO, em gases inócuos, em um curto espaço de tempo.

Os refrigeradores foram pontos importantes para a conservação de alimentos frescos, como carnes, frutas, hortaliças e recém-preparados. Isso porque, ao resfriarem o ambiente, desaceleram as reações químicas responsáveis pela deterioração dos alimentos.

O Brasil se destaca pela reciclagem de latas de alumínio. Contudo, tal metal é facilmente oxidado pelo oxigênio presente no ar, e como o processo de reciclagem envolve aquecimento (acelerando o ataque do alumínio pelo oxigênio) para fusão do metal, as latas de alumínios são alocadas em blocos. Dessa forma, a superfície de contato é menor, e as latas que ficam no interior do bloco não sofrem ação significativa do oxigênio presente no ar.

A cinética química também é aplicada no campo da medicina. A administração de um fármaco, seja via comprimido, intravenosa ou por aspiração, bem como sua metabolização em nosso organismo, é baseada em estudos cinéticos. Caso um paciente esteja sofrendo de dores intensas, como uma crise renal ou uma forte enxaqueca, a administração e a metabolização do fármaco devem ocorrer de forma que a dor seja cessada o mais rápido possível. Por isso que em emergências hospitalares, os medicamentos costumam ser administrados diretamente na veia, eliminando caminhos e aumentando a superfície de contato. Anestesias gerais são administradas por meio de gases, dando uma ação quase instantânea para o paciente.
Da mesma forma, a velocidade que um fármaco é eliminado também depende de modelos cinéticos. Um paciente que faça tratamento diário para hipertensão terá mais conforto se tomar um único comprimido por dia. Caso a velocidade de eliminação seja rápida demais, o paciente pode necessitar de mais comprimidos por dia, permitindo que o mesmo se esqueça ou confunda, pondo em risco o tratamento.
Os estudos cinéticos também permitem a datação de fósseis, rochas e outros artefatos da nossa natureza. São também modelos cinéticos que permitem predizer o tempo de decomposição de determinados materiais na natureza. Por exemplo, sabe-se que o tempo médio de decomposição de uma garrafa PET pode ser de 450 anos. Por mais que não houvesse garrafas PET há 450 anos, é possível traçar um modelo cinético que permita traçar a velocidade de decomposição desse material, projetando seu tempo total de decomposição.
Exercícios resolvidos sobre cinética química
Questão 1
(Uerj) Em um estudo de cinética química, foram realizados os experimentos W, X, Y e Z, nos quais o gás hidrogênio foi obtido a partir da reação química entre níquel e ácido clorídrico, conforme representado abaixo.
Ni (s) + 2 HCl (aq) → NiCl2 (aq) + H2 (g)
Em cada experimento, foram alteradas tanto a concentração do ácido clorídrico quanto a temperatura do sistema, mantendo-se a massa de níquel e o volume de solução do ácido constantes.
Observe o gráfico:
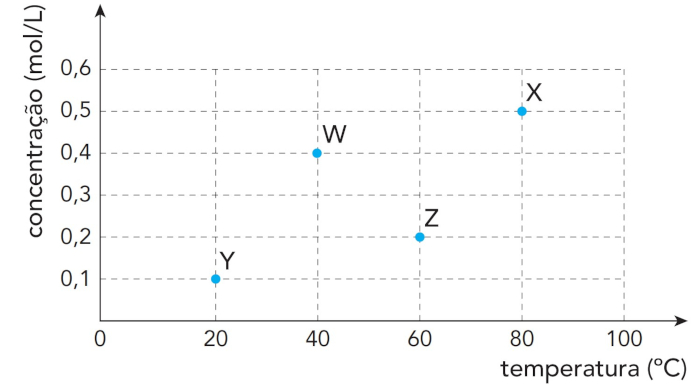
A maior velocidade inicial de formação de gás hidrogênio foi verificada no seguinte experimento:
A) W
B) X
C) Y
D) Z
Resolução:
Alternativa B.
Os dois fatores alterados foram a concentração de ácido clorídrico e a temperatura. Sabe-se que quanto maior a concentração de um reagente e maior a temperatura, maior a velocidade da reação química. Dessa forma, o experimento que junta essas duas alterações é o X, sendo este o de maior velocidade de formação de H2.
Questão 2
(Enem) O peróxido de hidrogênio é um produto secundário do metabolismo celular e apresenta algumas funções úteis, mas, quando em excesso, é prejudicial, gerando radicais que são tóxicos para as células. Para se defender, o organismo vivo utiliza a enzima catalase, que decompõe H2O2 em H2O e O2. A energia de reação de decomposição, quando na presença e ausência da catalase, está mostrada no gráfico.
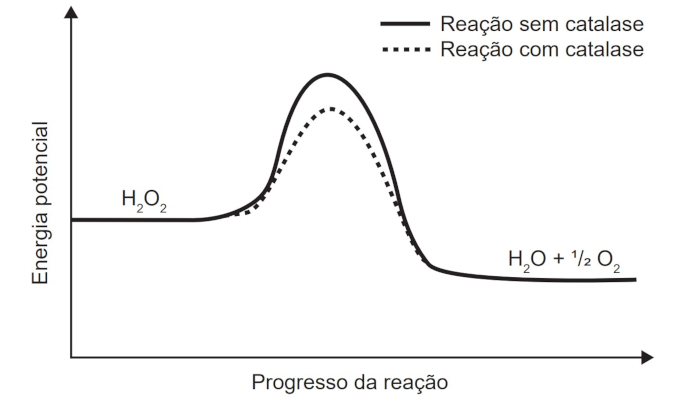
Disponível em www.pontociencia.org.br. Acesso em 14 ago. 2013. Adaptado
Na situação descrita, o organismo utiliza a catalase porque ela
A) diminui a energia de ativação.
B) permite maior rendimento da reação.
C) diminui o valor da entalpia da reação.
D) consome rapidamente o oxigênio do reagente.
E) reage rapidamente com o peróxido de hidrogênio.
Resolução:
Alternativa A.
A catalase é uma enzima, caracterizando-se como um catalisador. Isso é percebido no gráfico, pois a reação com catalase ocorre com menor energia de ativação. Assim sendo, o organismo utiliza a catalase pois esta, como catalisador, diminui a energia de ativação.
Crédito de imagem
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
BRASIL. Índice de reciclagem de latas de alumínio chega a 99% e Brasil se destaca como recordista mundial. 27 abr. 2022. Disponível em: https://www.gov.br/pt-br/noticias/meio-ambiente-e-clima/2022/04/indice-de-reciclagem-de-latas-de-aluminio-chega-a-99-e-brasil-se-destaca-como-recordista-mundial.
CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
ECYCLE. Tempo de decomposição do plástico preocupa. Disponível em: https://www.ecycle.com.br/tempo-de-decomposicao-do-plastico/.
FUNDAÇÃO CECIERJ. Estudo da velocidade das reações: cinética química. In: Química. Fascículo 5, unidade 13. Rio de Janeiro: Fundação CECIERJ, 2016.


