Concentração de soluções químicas em ppm

Para se determinar a concentração de soluções em termos de volume do soluto por volume da solução (V1/V), ou em termos de massa do soluto por massa da solução (m1/m), costuma-se utilizar o título (τ).
No entanto, existem casos em que a quantidade de soluto é extremamente pequena, como, por exemplo, a concentração dos poluentes existentes no ar, na terra e na água. Nessas situações, costuma-se usar a unidade partes por milhão, que é representada pela abreviação ppm.

Assim, uma solução de 20 ppm contém 20 gramas do soluto em 1 milhão de gramas da solução.
A relação matemática para a determinação do ppm pode ser dada por:

Se formos trabalhar com soluções gasosas, a concentração em ppm será expressa em volume; mas se estivermos falando de líquidos e sólidos, o ppm será dado em termos de massa.
É importante ressaltar que quando trabalhamos com soluções aquosas, em geral, a massa do soluto é muito pequena, por isso é costumeiro considerar a densidade da solução igual à da água líquida (1,0 g/mL) em trabalhos pouco rigorosos.
Algumas unidades de concentração que equivalem à relação 1 ppm são:
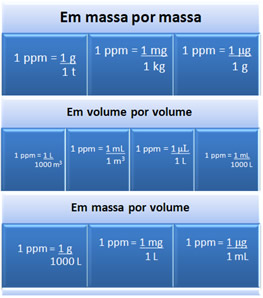
Há casos também em que a solução encontra-se ainda mais diluída e que é necessário expressar a concentração em partes por bilhão (ppb) e em partes por trilhão (ppt). O raciocínio para o trabalho com esses é o mesmo que no caso do ppm.

No cotidiano, o ppm aparece em várias situações. Por exemplo, nos rótulos dos cremes dentais costuma-se indicar a presença de flúor (na forma de algum sal). A embalagem abaixo mostra que esse produto apresenta um teor de flúor (na forma de fluoreto de sódio) de 1400 ppm. Isso significa que em cada 106 partes dessa solução (creme dental) existem 1400 . 106 partes de flúor.

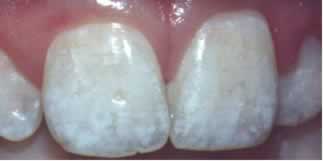
Esse dado é importante por vários motivos. Um deles é que os íons fluoreto podem ajudar a diminuir os casos de cárie. No entanto, crianças menores de 7 anos não podem ingerir regularmente flúor em excesso, porque podem desenvolver fluorose dental, que é uma doença em que os dentes apresentam pequenos pontos brancos parecidos com o aspecto do giz. Crianças que ingerem mais de 0,07 miligrama de íons fluoreto para cada miligrama de sua massa corporal por dia, correm sério risco de ter essa doença.
O ppb também é muito utilizado. Um exemplo é no caso da poluição das águas com metais pesados, como o chumbo. Esses metais apresentam o fenômeno da bioacumulação, isto é, suas concentrações aumentam, progressivamente, ao longo da cadeia alimentar. A água potável deve conter, no máximo, 15 ppb de chumbo, embora constantemente sejam encontradas águas com mais de 100 ppb.

Veja nos exemplos a seguir como trabalhar com o ppm:
Exemplo 1:
“A propanona pura, C3H6O, é um líquido volátil, incolor, inflamável, moderadamente tóxico, de sabor adocicado e cheiro agradável. Um ser humano comum pode perceber o cheiro da propanona diluída no ar na concentração mínima de 1,6 ppm. A análise de uma amostra do ar de determinado ambiente revelou que existe 0,00015% em volume de propanona. Uma pessoa, ao entrar no ambiente, irá perceber o odor da propanona?”
Resolução:
Aplicando na fórmula matemática do ppm citada no texto, temos:
1,6 ppm de C3H6O = _1,6 mL de C3H6O__
1 000 000 mL de ar
Visto que 1000 mL é igual a 1 L e que 1000 L é 1 m3, relacionamos que:
1 000 000 mL = 1 m3
Por isso, podemos substituir esse valor na expressão:
1,6 ppm de C3H6O = 1,6 mL de C3H6O
1 m3 de ar
Isso nos leva a concluir que cada m3 de ar contém 1,6 mL de C3H6O. Agora passamos a concentração para porcentagem da seguinte forma:
1,6 parte de C3H6O ------------- 1 000 000 partes de ar
x ------------------------------------ 100 partes de ar
x = 1,6 . 100 → x = __1,6__
1 000 000 10 000
x = 0,00016% de C3H6O no ar, em volume.
Como esse valor de 0,00016% está acima da porcentagem de 0,00015% citada no problema, então um ser humano não perceberá o odor da propanona.
Exemplo 2:
“De acordo com a padronização internacional, a água potável não pode conter mais do que 5,0 . 10-4 mg de mercúrio (Hg) por grama de água. Como essa quantidade máxima permitida de Hg pode ser expressa em ppm?”
Resolução:
ppm = massa do soluto em mg
massa do solvente em kg
Então:
ppm = 5,0 . 10-4 mg = 5,0 . 10-1 mg/kg = 5,0 . 10-1 ppm = 0,5 ppm
10-3 kg
Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias


















