Constante de Equilíbrio
Conforme dito no texto “Lei da Velocidade para uma Reação”, a velocidade de uma reação é diretamente proporcional às concentrações dos reagentes, conforme mostrado no caso genérico a seguir:
aA + bB → cC + dD
v = k . [A]α.[B]β
Onde: v = velocidade da reação;
k = constante característica de cada reação;
α e β = expoentes que são determinados experimentalmente.
No entanto, se essa for uma reação elementar, isto é, somente com uma etapa, podemos escrever essa expressão da seguinte forma:
v =k . [A]a.[B]b
Isso significa que os coeficientes serão os respectivos expoentes na expressão.
Mas se estivermos lidando com uma reação reversível, que em um determinado momento se encontra em equilíbrio químico, então poderemos realizar a expressão da velocidade tanto para a reação direta, como para a inversa:
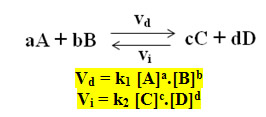
Onde: Vd = velocidade da reação direta;
Vi = velocidade da reação inversa.
Visto que a reação está em equilíbrio, a velocidade com que a reação direta se processa ou a sua taxa de desenvolvimento é exatamente igual à da reação inversa, logo:
Vd = Vi
k1 [A]a.[B]b= k2 [C]c.[D]d
k1 = k2 [C]c.[D]d
[A]a.[B]b
k1 = [C]c.[D]d
k2 [A]a.[B]b
Toda constante dividida por outra constante dá uma constante, assim a relação k1/k2 dá origem a uma constante que pode ser representada por Kc ou Ke, que é a constante de equilíbrio:

Há um ponto importante que devemos observar: somente fazem parte dessa expressão as concentrações em quantidade de matéria que podem sofrer variação como em sistemas gasosos e em soluções líquidas.
Visto que a concentração em quantidade de matéria de uma substância no estado sólido é constante, seu valor já está incluso no próprio valor de Kc e, portanto, não é preciso escrevê-lo na expressão.
Observe as reações abaixo e suas constantes de equilíbrio:
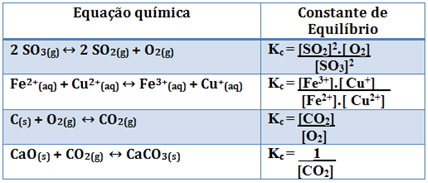
Observe que no 1º e no 2º casos todas as substâncias foram escritas na expressão da constante de equilíbrio, pois estão no estado gasoso ou aquoso, o que significa que estão sujeitas a variação. Já nos dois últimos exemplos, as substâncias que estão no estado sólido não foram transcritas na expressão.