Equilíbrio químico
Equilíbrio químico é um equilíbrio dinâmico do processo reacional, em que as reações ocorrem em ambos os sentidos e com a mesma velocidade. Uma consequência de uma reação em equilíbrio é que a composição do sistema não muda, uma vez que as concentrações dos participantes são constantes.
O equilíbrio químico, sendo dinâmico, é sensível às alterações de concentração, temperatura e pressão. Isso foi explorado por Le Chatelier para desenvolver seu princípio de deslocamento de equilíbrios químicos. Também é importante dizer que todo equilíbrio químico tem uma constante que demonstra em que ponto da reação o equilíbrio foi estabelecido.
Leia também: O que pode alterar a velocidade de uma reação química?
Resumo sobre equilíbrio químico
- Equilíbrio químico é um equilíbrio dinâmico que as reações químicas atingem depois das velocidades das reações do sentido direto e inverso se igualarem.
- Quando o equilíbrio é atingido, a composição química do sistema não muda, uma vez que a concentração dos participantes se torna constante.
- Um equilíbrio químico tem uma grandeza termodinâmica conhecida como constante de equilíbrio, que demonstra em que ponto do processo reacional o equilíbrio foi estabelecido.
- Sendo um equilíbrio dinâmico, o equilíbrio químico é sensível às alterações de pressão, concentração e volume.
- Essa sensibilidade do equilíbrio químico foi explorada por Le Chatelier para enunciar seu princípio de deslocamento de equilíbrio.
Videoaula sobre equilíbrio químico
O que é equilíbrio químico?
![Fórmulas estruturais de duas reações reversíveis, que caracterizam o equilíbrio químico. [imagem_principal]](https://static.mundoeducacao.uol.com.br/mundoeducacao/2025/06/equilibrio-quimico.jpg)
As reações químicas são processos reversíveis, ou seja, a reação pode ocorrer no sentido direto (→) e inverso (←). Contudo, a partir de determinado ponto, as velocidades das reações químicas em ambos os sentidos adquirem a mesma velocidade, estabelecendo o equilíbrio químico, um estado de equilíbrio dinâmico em que ambos os sentidos da reação não deixam de ocorrer, e os reagentes e os produtos estão sendo consumidos e preparados na mesma velocidade.
Como resultado, as concentrações dos participantes permanecem constantes após o estabelecimento do equilíbrio e, dessa forma, não há mais tendência de formar mais reagentes ou mais produtos.
Como funciona o equilíbrio químico?
Embora, em teoria, toda reação seja reversível, na prática percebemos que algumas reações parecem que se completam, como é o caso de reações de combustão e explosivas. Mas, em outras reações, isso fica mais explícito e, neste caso, vamos utilizar a produção do gás amônia, NH3, a partir dos gases nitrogênio, N2, e hidrogênio, H2.
Inicialmente, os reagentes N2 e H2 reagem, formando as primeiras quantidades de NH3.
N2 (g) + 3 H2 (g) → 2 NH3 (g)
Depois de um tempo, a quantidade de amônia produzida parece estagnar, mas o que ocorre de fato é que a velocidade da reação inversa começa a se tornar significativa:
2 NH3 (g) → N2 (g) + 3 H2 (g)
Depois de um tempo, as velocidades de ambas as reações se igualam, ou seja, a amônia se decompõe na mesma velocidade que é formada. Quando isso ocorre, a reação química atinge o equilíbrio químico. Uma reação em equilíbrio é indicada por uma dupla seta ou um duplo arpão (⇌).
N2 (g) + 3 H2 (g) ⇌ 2 NH3 (g)
É sempre bom lembrar que os equilíbrios químicos são dinâmicos, ou seja, são sensíveis às mudanças de temperatura, pressão e às adição ou remoção de determinada quantidade de um participante, por menor que seja.
Veja também: O que é o pH de uma solução?
Gráficos de equilíbrio químico
O gráfico a seguir demonstra o comportamento esperado para as velocidades das reações que ocorrem no sentido direto e inverso. Perceba que a velocidade da reação no sentido direto vai abaixando com o tempo, uma vez que a quantidade de reagentes vai diminuindo. Concomitantemente, a velocidade da reação direta começa a subir devido ao surgimento dos produtos da reação. Quando essas velocidades se igualam, a reação química entra em equilíbrio químico:
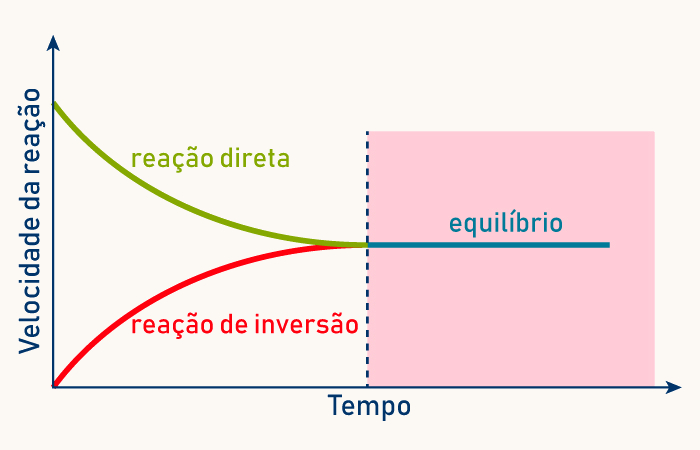
Quando avaliamos os gráficos de concentração pelo tempo, percebemos que o equilíbrio pode ser observado quando a concentração dos participantes da reação fica constante com o tempo.
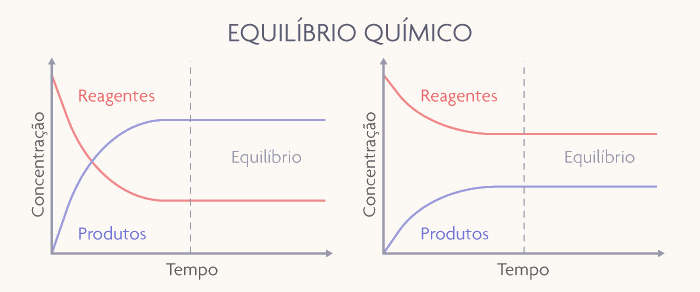
Nos gráficos demonstrados acima ocorrem dois tipos de equilíbrios químicos estabelecidos. No gráfico à esquerda, a quantidade de produtos é maior que a dos reagentes no equilíbrio; já no gráfico à direita, a quantidade de produtos é menor que a dos reagentes no equilíbrio. Em ambos os casos, reitera-se, o equilíbrio só se estabelece a partir do momento que as concentrações deixam de variar com o tempo.
Para a reação vista na seção anterior (N2 (g) + 3 H2 (g) ⇌ 2 NH3 (g)), o gráfico das concentrações dos participantes é o que se segue:
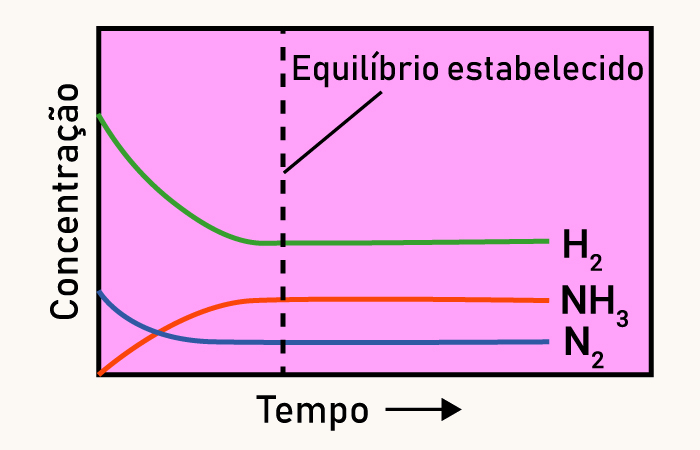
Repare que a queda da concentração de H2 é mais abrupta que de N2. Isso ocorre porque, para cada 1 mol de N2 que reage, 3 mols de H2 reagem ao mesmo tempo.
Tipos de equilíbrio químico
Basicamente existem dois tipos de equilíbrios químicos: o equilíbrio químico homogêneo e o equilíbrio químico heterogêneo.
→ Equilíbrio químico homogêneo
É o caso em que todos os participantes do equilíbrio químico estão na mesma fase, consistindo em um sistema homogêneo (monofásico). São exemplos de equilíbrios homogêneos:
N2 (g) + 3 H2 (g) ⇌ 2 NH3 (g)
2 N2O5 (g) ⇌ 4 NO2 (g) + O2 (g)
CH3COOH (l) + C2H5OH (l) ⇌ CH3COOC2H5 (l) + H2O (l)
KCN (aq) + H2O (l) ⇌ HCN (aq) + KOH (aq)
→ Equilíbrio químico heterogêneo
É o caso em que os participantes do equilíbrio estão presentes em mais de uma fase. São exemplos de equilíbrios heterogêneos:
Fe (s) + 4 H2O (g) ⇌ Fe3O4 (s) + 4 H2 (g)
CaCO3 (s) ⇌ CaO (s) + CO2 (g)
AgCl (s) ⇌ Ag+ (aq) + Cl− (aq)
Leis do equilíbrio químico
Um equilíbrio químico tem duas leis que auxiliam na descrição do processo. A primeira delas é a lei da ação das massas, ou lei de Guldberg-Waage (em alusão aos cientistas que a enunciaram). Segundo essa lei, também muito útil na cinética química, as concentrações ou pressões parciais dos participantes do equilíbrio, independentemente das quantidades iniciais, estabelecem uma razão constante, desde que a reação se propague em temperatura e pressão constantes.
Outra lei de grande auxílio é o princípio de Le Chatelier, também em alusão ao cientista que o elaborou. Segundo esse princípio, caso uma perturbação externa seja feita no equilíbrio químico, este irá se comportar para minimizar tais perturbações, de modo a restabelecer a condição de equilíbrio. Essas alterações podem ser em condições físicas do equilíbrio, como temperatura e pressão, ou nas condições reacionais, alterando-se a concentração dos participantes.
Características do equilíbrio químico
Após a definição de alguns aspectos introdutórios, podemos estabelecer as principais características dos equilíbrios químicos:
- Um equilíbrio químico é alcançado quando a velocidade das reações químicas direta e inversa se igualam.
- Para que o equilíbrio químico ocorra, a temperatura, a pressão e a concentração dos participantes devem permanecer constantes.
- O estabelecimento do equilíbrio químico não faz a reação parar, mas as quantidades dos participantes não se alteram mais.
- O equilíbrio pode ser alcançado iniciando-se a reação por qualquer lado, ou seja, na reação n2 (g) + 3 h2 (g) ⇌ 2 nh3 (g), o equilíbrio também poderia ser atingido caso fosse iniciado com n2 e h2 ou apenas nh3.
- O equilíbrio químico só pode ser alcançado em um sistema fechado, para impedir o escape de reagentes e produtos, já que, por ser um equilíbrio dinâmico, qualquer alteração nas concentrações dos participantes afeta a condição de equilíbrio.
- Catalisadores não afetam o equilíbrio químico, uma vez que eles aceleram ambos os sentidos reacionais na mesma proporção, não trazendo alterações nas concentrações dos participantes do equilíbrio; porém fazem com que o equilíbrio químico seja atingido mais rapidamente.
Constante de equilíbrio químico
Em 1864, os noruegueses Cato Guldberg e Peter Waage descobriram uma relação matemática dentro dos equilíbrios químicos, a chamada lei da ação das massas.
Para a seguinte reação:
N2 (g) + 3 H2 (g) ⇌ 2 NH3 (g)
Guldberg e Waage perceberam que, independentemente da composição inicial, mas em temperatura e pressão constantes, o equilíbrio sempre seguia a seguinte expressão:
\(K = \frac{(p_{NH_3})^2}{(p_{N_2}) \cdot (p_{H_2})^3}\)
Em que p é a pressão parcial de cada gás participante na reação e K, por ser um valor constante, tornou-se a “constante de equilíbrio”. Repare que os coeficientes estequiométricos se tornam expoentes na expressão do K e que os produtos da reação direta figuram no numerador, enquanto os reagentes da reação direta figuram no denominador.
A pressão parcial só é descrita para gases e, dessa forma, no seguinte equilíbrio:
CaCO3 (s) ⇌ CaO (s) + CO2 (g)
A expressão da constante de equilíbrio é:
K = pCO2
Já que CO2 é o único constituinte gasoso para o equilíbrio químico descrito.
Um equilíbrio pode ser descrito tanto em pressões parciais, quanto em concentração de soluto em uma solução diluída. Nesse caso, observemos o equilíbrio:
AgCl (s) ⇌ Ag+ (aq) + Cl− (aq)
A expressão da constante de equilíbrio, em função da concentração dos solutos presentes na solução diluída, é:
K = [Ag+] [Cl-]
As concentrações (sempre em mol∙L−1) são representadas, na notação do K, por colchetes. Assim como substâncias não gasosas não participam da expressão da constante de equilíbrio quando ela está em função das pressões parciais, líquidos e sólidos puros também não figuram na expressão da constante de equilíbrio quando ela está em função de concentração. Por conta disso, a concentração de AgCl não figurou na expressão anteriormente apresentada.
Como a constante de equilíbrio pode ser descrita em termos de pressões parciais dos componentes gasosos ou das concentrações de solutos em soluções diluídas, é comum autores distinguirem essas constantes em KP e KC, em que KP é a constante de equilíbrio para pressões parciais e KC é a constante de equilíbrio para concentração.
-
Conversão entre KC e KP
É possível fazer uma rápida interconversão entre KC e KP. Para isso, basta considerar que os gases estão em condições ideais e, assim, obedecendo à equação de Clapeyron: PV = nRT.
Como n/V é igual à concentração molar, M, podemos reescrever a equação de Clapeyron da seguinte forma: P = MRT.
Assim, para o sistema:
\(a\,A\,(g) + b\,B\,(g) \rightleftharpoons \underset{..}{c}\,C\,(g) + d\,D\,(g)\)
Temos a seguinte expressão de KP:
\(K_P = \frac{(p_C)^c \cdot (p_D)^d}{(p|A)^a \cdot (p|B)^b}\)
Substituindo o valor da pressão pelas concentrações, temos que:
\(K_P = \frac{([C]RT)^c \cdot ([D]RT)^d}{([A]RT)^a \cdot ([B]RT)^b}\)
Agora, podemos dividir a expressão obtida em duas partes:
\(K_P = \frac{[C]^c \cdot [D]^d}{[A]^a \cdot [B]^b} \cdot \frac{RT^c \cdot RT^d}{RT^a \cdot RT^b} \)
Ainda organizando a reação, temos que:
\(K_P = K_C \cdot \frac{RT^{c+d}}{RT^{a+b}} \;\to\; K_P = K_C \cdot RT^{(c+d)-(a+b)} \;\to\; K_P = K_C \cdot RT^{\Delta n}\)
Por fim, note que Δn = (somatório dos coeficientes dos produtos) − (somatório dos coeficientes dos reagentes).
Para o equilíbrio N2 (g) + 3 H2 (g) ⇌ 2 NH3 (g), por exemplo, a conversão entre KP e KC é dada pela seguinte expressão:
KP = KC ∙ RT2-(1+3) → KP = KC ∙ RT-2
-
Constante de equilíbrio em processos múltiplos
A constante de equilíbrio sofre alterações de acordo com o que é feito no equilíbrio químico. Por exemplo, temos o equilíbrio:
PCl3 (g) + Cl2 (g) ⇌ PCl5 (g)
A constante KC é dada por:
\(K_C = \frac{[PCl_5]}{[PCl|3] \cdot [Cl|2]}\)
Para o equilíbrio inverso, temos que:
PCl5 (g) ⇌ PCl3 (g) + Cl2 (g)
Assim, o valor de K’C é:
\(K'_C = \frac{[PCl|3] \cdot [Cl|2]}{[PCl_5]} = \frac{1}{K_C}\)
Se o equilíbrio for dobrado:
2 PCl3 (g) + 2 Cl2 (g) ⇌ 2 PCl5 (g)
Estabelecemos um K”C, o quadrado de KC:
\(K''_C = (K_C)^2 = \frac{[PCl_5]^2}{[PCl_3]^2 [Cl_2]^2}\)
Se temos uma sequência de reações que se somam para estabelecimento de uma reação global, a constante de equilíbrio do processo global será o produto das constantes de equilíbrio. Por exemplo, para formarmos o equilíbrio 2 P (g) + 5 Cl2 (g) ⇌ 2 PCl5 (g), podemos usar os dois equilíbrios a seguir:
2 P (g) + 3 Cl2 (g) ⇌ 2 PCl3 (g) K1
PCl5 (g) ⇌ PCl3 (g) + Cl2 (g) K2
Para formar o equilíbrio de interesse, o segundo equilíbrio deve ser dobrado:
2 P (g) + 3 Cl2 (g) ⇌ 2 PCl3 (g) K1
2 PCl5 (g) ⇌ 2 PCl3 (g) + 2 Cl2 (g) (K2)2
______________________________________________________________________________________________________________
2 P (g) + 5 Cl2 (g) ⇌ 2 PCl5 (g) K3 = K1 ∙ (K2)2
Como calcular o equilíbrio químico?
A determinação dos valores das espécies no equilíbrio é feita por uma metodologia de cálculo que segue algumas etapas específicas. Vejamos o caso a seguir.
Suponhamos que temos o seguinte equilíbrio:
PCl5 (g) ⇌ PCl3 (g) + Cl2 (g)
Para esse equilíbrio, vamos dizer que 417 gramas de PCl5 foram colocados em um recipiente de 4 litros na temperatura de 250 °C. Nessas condições, o valor de KC é igual a 0,04.
Como a massa molar de PCl5 é igual a 208,5 g/mol, então podemos calcular o número de mols de PCl5 pela expressão n = m/MM:
n = m/MM
n = 417 g / 208,5 g/mol
n = 2 mols de PCl5
Com isso, montamos a seguinte tabela para mapear a variação dos participantes ao longo do processo químico:
|
Substância |
PCl5 |
PCl3 |
Cl2 |
|
Início |
2 |
0 |
0 |
|
Reação |
−x |
+x |
+x |
|
Equilíbrio |
2 – x |
x |
x |
Como PCl5 é um reagente, há um consumo de x mols desse composto ao longo da reação. Como a reação é de 1:1:1, ou seja, para cada 1 mol de PCl5 há 1 mol de PCl3 e 1 mol de Cl2, então foram formados x mols de PCl3 e Cl2, proporcional.
Com isso, a expressão do KC é:
\(K_C = \frac{[PCl_5]}{[PCl|3] \cdot [Cl|2]}\)
\(K_C = \frac{\dfrac{2 - x}{4}}{\dfrac{x}{4} \cdot \dfrac{x}{4}}\)
\(K_C = \frac{2 - x}{\dfrac{x^2}{4}} \Rightarrow \frac{K_C}{4} = \frac{2 - x}{x^2}\)
Substituindo o valor de KC:
\(\frac{0{,}04}{4} = \frac{2 - x}{x^2}\)
\(0{,}01 = \frac{2 - x}{x^2} \)
\(0,01x^2+x-2=0\)
As raízes possíveis de x são 1,95 e −101,95. Como não existe valor negativo para o número de mols, então podemos dizer que o número de mols de PCl5, PCl3 e Cl2 no equilíbrio são, respectivamente, 0,05 mol, 1,95 mol e 1,95 mol. As concentrações deles no equilíbrio serão obtidas ao se dividir pelo volume (4 litros): respectivamente 0,0125 mol/L; 0,4875 mol/L e 0,4875 mol/L.
Deslocamento do equilíbrio químico
Já foi dito em tópicos anteriores deste texto que o equilíbrio químico é dinâmico, ou seja, é sensível às mudanças de temperatura, pressão e concentração dos participantes. Foi com base nisso que o francês Henri le Chatelier identificou o seguinte princípio:
|
Quando uma perturbação é aplicada em um sistema em equilíbrio dinâmico, ele tende a se reajustar para reduzir ao mínimo o efeito da perturbação. |
O que Le Chatelier fundamentou foi a noção de deslocamento do equilíbrio químico. Em outras palavras, ele diz que o equilíbrio sempre tentará se restabelecer, apesar das perturbações.
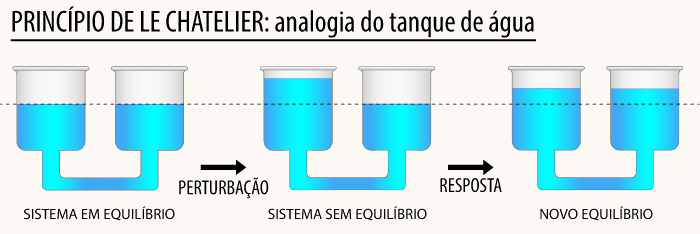
Embora seja empírica (baseada em observações), é uma regra prática, não permitindo explicações formais ou predições quantitativas. Contudo, a grande base cinética e termodinâmica do princípio de Le Chatelier permite conclusões bastante robustas. Três são os fatores que podem alterar um equilíbrio químico:
- a concentração dos participantes;
- a pressão;
- a temperatura.
Para verificar e analisar cada uma delas, vamos tomar como exemplo o processo de síntese da amônia, enunciado pelo equilíbrio:
N2 (g) + 3 H2 (g) ⇌ 2 NH3 (g)
→ Concentração
Imagine que uma certa quantidade de N2 ou H2 tenha sido adicionada após o estabelecimento do equilíbrio químico. Segundo o princípio de Le Chatelier, o equilíbrio se comporta para minimizar tal ação. Sendo assim, qual a resposta esperada?
Reduzir esse aumento na quantidade de reagentes por aumento na velocidade da produção de NH3. Da mesma forma, o aumento de amônia após o estabelecimento do equilíbrio faz com que o sistema aumente a velocidade de consumo de NH3, aumentando as concentrações de N2 e H2.
Assim, podemos resumir que:
|
Ação |
Efeito |
Consequência |
|
Aumento da concentração dos reagentes. |
O equilíbrio aumenta o consumo dos reagentes para minimizar o aumento de concentração. |
Há maior geração de produtos. |
|
Aumento da concentração dos produtos. |
O equilíbrio aumenta o consumo dos produtos para minimizar o aumento de concentração. |
Há maior geração de reagentes. |
|
Diminuição da concentração dos reagentes. |
O equilíbrio aumenta o consumo dos produtos para minimizar a redução da concentração. |
Há maior geração de reagentes. |
|
Diminuição da concentração dos produtos |
O equilíbrio aumenta o consumo dos reagentes para minimizar a redução da concentração. |
Há maior geração de produtos. |
→ Pressão
Equilíbrios que tenham gases podem responder às alterações de pressão (e, consequentemente, de volume) que são exercidas no recipiente reacional. Dentro do princípio de Le Chatelier, o equilíbrio deve se comportar para minimizar efeitos causados por alterações de pressão. Tomando o equilíbrio de síntese de amônia, percebe-se que há 4 mols gasosos do lado dos reagentes (1 mol do N2, com 3 mols de H2), enquanto há apenas 2 mols gasosos do lado dos produtos.
Um lado com maior número de mols gasosos apresenta maior pressão, já que um maior número de mols gasosos apresenta um maior número de colisões nas paredes do recipiente reacional, o que faz elevar a pressão.
Assim sendo, o aumento da pressão sobre o sistema em equilíbrio favorece a formação de NH3, pois, pelo fato desse lado da reação ter menor pressão (menos mols gasosos), minimiza o efeito causado pelo aumento da pressão.
De forma contrária, a diminuição da pressão sobre o sistema em equilíbrio favorece a formação dos reagentes, pois, como esse lado reacional tem maior pressão (mais mols gasosos), minimiza o efeito causado pela descompressão total.
→ Temperatura
A temperatura é um fator capaz de deslocar o equilíbrio químico. A relação da temperatura com o equilíbrio está intimamente ligada com o fato de uma reação ser endotérmica (absorve calor) ou exotérmica (libera calor). Para início de avaliação, em um equilíbrio químico, caso um sentido seja endotérmico, o sentido inverso será exotérmico.
No caso do equilíbrio químico que estamos usando como exemplo, a produção de amônia (sentido direto) é um processo exotérmico; enquanto a produção dos reagentes (sentido inverso) é um processo endotérmico.
Experimentalmente, percebeu-se que o aumento da temperatura diminui a constante de equilíbrio (K) de uma reação exotérmica. Isso significa que no equilíbrio:
N2 (g) + 3 H2 (g) ⇌ 2 NH3 (g)
a fração dos reagentes aumenta, enquanto nos produtos diminui, porque quanto menor o K, maior o denominador e menor o numerador, ou seja, maior a participação de produtos e menor a participação de reagentes.
Pelo princípio de Le Chatelier isso faz todo sentido, pois uma reação exotérmica acompanha uma liberação de calor para a vizinhança, o que causa um aumento da temperatura do sistema reacional. Perturbar o sistema em equilíbrio com um aumento de temperatura irá desfavorecer o sentido exotérmico como forma de minimizar o aumento da temperatura.
Da mesma forma, experimentalmente, percebeu-se que o aumento da temperatura aumenta a constante de equilíbrio de uma reação endotérmica. No equilíbrio em questão, a constante de equilíbrio para o sentido endotérmico é:
\(K_{\text{endo}} = \frac{[N_2] \cdot [H_2]^3}{[NH_3]^2}\)
que é justamente o inverso da constante de equilíbrio do sentido exotérmico. Se o aumento da temperatura aumenta a constante de equilíbrio endotérmica, então percebemos que o sentido endotérmico é favorecido pelo aumento de temperatura.
Isso faz sentido dentro da ótica do princípio de Le Chatelier, pois as reações endotérmicas absorvem calor da vizinhança, causando uma diminuição da temperatura do meio reacional. O aumento de temperatura, portanto, minimiza essa queda na temperatura.
Assim sendo, o aumento da temperatura não favorece a reação exotérmica, deslocando o equilíbrio em direção ao sentido endotérmico. O favorecimento do sentido exotérmico do equilíbrio, então, se dá por diminuição da temperatura do sistema reacional, já que a energia liberada pelo processo exotérmico minimiza a queda de temperatura.
Saiba mais: Termodinâmica — leis, fórmulas e os principais conceitos
Exercícios resolvidos sobre equilíbrio químico
Questão 1. (UFT Tarde/2025.1) A adição de ácido nítrico (HNO3) concentrado em um fio de cobre metálico produz o gás dióxido de nitrogênio (NO2). Se esta reação for feita em um sistema fechado, como em um balão volumétrico, o NO2 forma o gás tetróxido de dinitrogênio (N2O4), conforme a equação do equilíbrio a seguir:
|
2 NO2 (g) |
⇌ |
N2O4 (g) |
ΔH < 0 |
|
castanho |
|
incolor |
|
A partir do equilíbrio apresentado, assinale a única alternativa INCORRETA:
A) Quando o balão volumétrico contendo a mistura em equilíbrio é resfriado, a intensidade da coloração castanha diminui.
B) Se a mistura em equilíbrio for transferida para um sistema fechado com volume maior, na mesma temperatura, haverá intensificação da coloração castanha pela formação de mais NO2.
C) Ocorre um aumento do valor da constante de equilíbrio quando o balão volumétrico contendo a mistura em equilíbrio é aquecido.
D) Um aumento da pressão sobre o equilíbrio do sistema em análise, promove um aumento da concentração de N2O4, diminuindo a intensidade da coloração castanha.
Resposta: Letra C.
Quando o balão é aquecido, o equilíbrio favorece o lado endotérmico, ou seja, o de formação de NO2. Consequentemente, a constante de equilíbrio diminui, pois o denominador se torna maior e o numerador se torna maior. A alternativa C afirma que a constante aumentaria, o que está incorreto.
Questão 2. (Uece 1ª Fase/2024.2) Ao estudar uma reação química que se encontra em equilíbrio químico, dependendo das condições, deve-se considerar a constante de equilíbrio em função das concentrações (Kc) e a constante de equilíbrio em função das pressões parciais (Kp).
Assinale a opção que corresponde à reação química em que Kc = Kp.
A) 2 NO (g) + Cℓ2 (g) ⇌ 2 NOCℓ (g)
B) PCℓ5 (g) ⇌ PCℓ3 (g) + Cℓ2 (g)
C) N2 (g) + O2 (g) ⇌ 2 NO (g)
D) CaO (s) + CO2 (g) ⇌ CaCO3 (s)
Resposta: Letra C.
A relação entre KC e KP é dada por:
\(K_P = K_C \cdot RT^{(c+d)-(a+b)} \Rightarrow K_P = K_C \cdot RT^{\Delta n} \)
Com isso, percebe-se que, para KP = KC, o valor de Δn tem que ser 0, assim, RT será igual a 1.
Para Δn ser igual a 0, o somatório dos coeficientes estequiométricos dos reagentes deve ser o mesmo dos produtos. Isso é observado na reação da alternativa C, em que há 2 mols de reagentes (1 de N2 e mais 1 de O2) e mais 2 mols no produto (NO).
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
FRANCISCO, F. M.; DO CANTO, E. L. Química na abordagem do cotidiano. 5ª ed. vol. 1. São Paulo: Moderna, 2009.
REIS, M. Química: ensino médio. 2ª ed. vol. 1. São Paulo: Ática, 2016.
USBERCO, J.; SPITALERI, P.; SALVADOR, E. Química 1: conecte live. 3ª ed. vol. 1. São Paulo: Saraiva, 2018.

