Eletroafinidade ou Afinidade Eletrônica
Muitos átomos podem se transformar em ânions, isto é, elementos carregados (íons) negativamente. Para que isso ocorra basta que o elemento ganhe elétrons. Quando um átomo isolado no estado gasoso recebe um elétron, há uma liberação de energia, que é medida pela eletroafinidade ou afinidade eletrônica.
X(g) + e- → X-(g) + energia
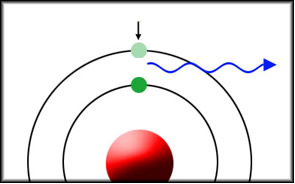
Como o próprio nome diz, a eletroafinidade mede o grau de afinidade ou a intensidade da atração do átomo pelo elétron adicionado.
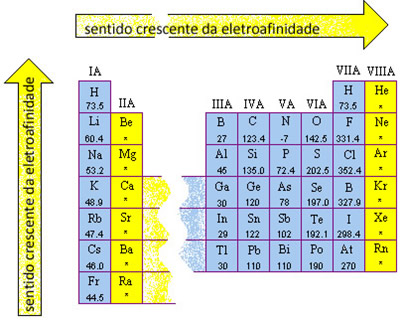
No entanto, a afinidade eletrônica é difícil de ser medida e, em razão disso, foram determinadas somente para alguns elementos na Tabela Periódica. Apesar disso, com os valores obtidos é possível realizar uma generalização de como a eletroafinidade varia na Tabela.
Por exemplo, o lítio (Li) e o potássio (K) são da mesma família ou grupo, sendo que a eletroafinidade do lítio medida experimentalmente é igual a 60 kJ e a do potássio é 48. O mesmo é verificado no caso do flúor (F) e do bromo (Br), que pertencem à família 17 ou VII A. O flúor é do 2º período, tendo a eletroafinidade igual a 328 kJ, enquanto que o bromo que é do 3º período, ou seja, abaixo do flúor, e possui a afinidade eletrônica igual a 325 kJ.
Isso mostra que em uma mesma família, quanto maior o período, menor será a eletroafinidade, ou seja, essa propriedade periódica cresce de baixo para cima na Tabela Periódica.
Agora, com os mesmos valores mencionados, vamos comparar os elementos que são do mesmo período na Tabela Periódica. O lítio é do mesmo período que o flúor e a afinidade eletrônica do flúor é bem maior. O potássio e o bromo pertencem ao 3º período, sendo que a eletroafinidade do bromo é a maior.
Essa informação leva à generalização de que na Tabela Periódica, em um mesmo período, quanto maior a família, maior será a afinidade eletrônica; isto é, ela cresce da esquerda para a direita. Veja isso na Tabela abaixo com os valores das eletroafinidades sobre os elementos; o asterisco indica que ainda não se determinou experimentalmente a afinidade eletrônica de tal elemento.
Isso nos ajuda a estabelecer também outra relação:

Portanto, os elementos que possuem maiores eletroafinidades são os halogênios (elementos da família 17 ou VIIA) e o oxigênio.

