Mistura de soluções com solutos diferentes

Imagine que misturemos 1 L de solução aquosa de cloreto de sódio (NaCl – sal de cozinha) a 0,1 mol/L com 1 L de uma solução aquosa de sacarose (C12H22O11 – açúcar comum) a 0,2 mol/L. O solvente de ambas as soluções é o mesmo: a água. Porém, os solutos são diferentes: sal e açúcar, de modo que se originou uma nova solução.
Entretanto, esses solutos não reagem entre si, eles estão simplesmente diluídos num volume maior de solução. Na solução inicial havia 0,1 mol de sal em 1 L de solução, agora há 0,1 mol de sal dissolvido em 2 L de solução. O mesmo raciocínio se aplica à solução de sacarose, que tinha 0,2 mol de açúcar dissolvido em 1 L e agora esse 0,2 mol está dissolvido em 2 L de solução:
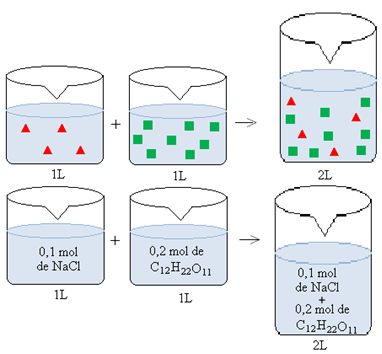
Assim, se quisermos descobrir a concentração em mol/L do sal e do açúcar nessa nova solução, devemos considerar como se cada solução tivesse sofrido uma simples diluição. Isso pode ser feito de duas formas. Na primeira, basta usar a fórmula da concentração em mol/L (M = n/V) para cada solução:
* NaCl: * C12H22O11:
M = n M = n
V V
M = 0,1 mol M = 0,2 mol
2 L 2 L
M = 0,05 mol/L M = 0,1 mol/L
Agora temos 0,05 mol de NaCl e 0,1 mol de C12H22O11 dissolvidos em cada litro da solução.
Outra forma de resolver essa questão é usar o que foi explicado no texto Diluição de Soluções. Ele trouxe a seguinte relação:
Minicial . Vinicial = Mfinal . Vfinal
Podemos usá-la da seguinte forma:
* NaCl: * C12H22O11:
Minicial . Vinicial = Mfinal . Vfinal Minicial . Vinicial = Mfinal . Vfinal
0,1 mol/L . 1 L = Mfinal . 2 L 0,2 mol/L . 1 L = Mfinal . 2 L
Mfinal = 0,1 mol Mfinal = 0,2 mol
2L 2L
Mfinal = 0,05 mol/L Mfinal =0,1 mol/L
Essa relação também se aplica a todas as outras formas de concentração.
Mas e se os solutos sofrerem ionização ou dissociação iônica em meio aquoso? Como determinar a concentração de cada um dos íons na nova solução formada?
Para tal será necessário escrever as equações de ionização ou dissociação de cada soluto e usar a proporção estequiométrica para determinar a concentração dos íons formados.
Por exemplo, considere que foram misturados 250 mL de uma solução aquosa de K2SO4 a 0,5 mol/L com 150 mL de uma solução aquosa de Al2(SO4)3 a 0,8 mol/L. Qual seria a concentração em mol/L de cada um dos íons formados na solução final?
1º passo: Escrever as reações de dissociação dos sais:
1 K2SO4(aq) → 2 K+(aq) + 1 SO42-
↓ ↓ ↓
1 mol 2 mol 1 mol
↓ ↓ ↓
0,5 mol/L 1,0 mol/L 0,5 mol/L
1 Al2(SO4)3(aq) → 2 Al3+(aq) + 3 SO42-
↓ ↓ ↓
1 mol 2 mol 3 mol
↓ ↓ ↓
0,8 mol/L 1,6 mol/L 2,4 mol/L
2º passo: Agora vamos fazer os cálculos para cada íon:
- K+(aq):
Minicial . Vinicial = Mfinal . Vfinal
1,0 mol/L . 0,25 L = Mfinal . 0,4 L
Mfinal = 0,25 mol
0,4L
Mfinal = 0,625 mol/L de K+(aq) na solução final
- Al3+(aq):
Minicial . Vinicial = Mfinal . Vfinal
1,6 mol/L . 0,15 L = Mfinal . 0,4 L
Mfinal = 0,24 mol
0,4L
Mfinal = 0,6 mol/L de Al3+(aq) na solução final
- SO42-(aq) (ele estava presente nas duas soluções):
Minicial . Vinicial + Minicial . Vinicial = Mfinal . Vfinal
(0,5 mol/L . 0,25 L) + ( 2,4 mol/L . 0,15 L) = Mfinal . 0,4 L
(0,125 mol) + ( 0,36 mol) = Mfinal . 0,4 L
Mfinal = 0,485 mol
0,4L
Mfinal = 1,2125 mol/L de SO42- (aq) na solução final
Ferramentas Brasil Escola


Últimas notícias
Outras matérias


















