Diluição de Soluções
Fazemos uma diluição quando adicionamos mais solvente a uma solução já existente, de modo que a concentração da solução diminua.
No cotidiano é muito comum realizarmos diluições. Por exemplo, geralmente os rótulos de sucos concentrados indicam que o preparado desses sucos deve ser feito acrescentando-se água numa proporção determinada. Quando fazemos isso, estamos diluindo o suco.

Atenção: Não confunda diluição com dissolução. Quando estamos fazendo um suco e adicionamos o soluto (refresco em pó, por exemplo) ao solvente (água), está ocorrendo uma dissolução. Mas quando acrescentamos mais água a uma solução de água com refresco em pó, temos uma diluição.
Essa prática também é muito comum nos laboratórios, pois geralmente as soluções que são comercializadas vêm numa concentração bem alta e, de acordo com a finalidade, os cientistas preparam soluções mais diluídas a partir da solução inicial.
Essas soluções costumam ser preparadas pegando-se uma alíquota, isto é, uma parte da solução inicial com uma pipeta, que é um instrumento utilizado para medir e transferir volumes de líquidos com alta precisão. Essa alíquota é transferida para um balão volumétrico e, por último, acrescenta-se a água até atingir o volume desejado e indicado pelo balão volumétrico.

Mas surge uma pergunta: Como saber o volume da alíquota que se deve pegar para preparar a solução?
Bem, isso depende de qual concentração queremos que a solução tenha. Quando realizamos uma diluição, a massa do soluto permanece inalterada, como mostra a imagem abaixo:
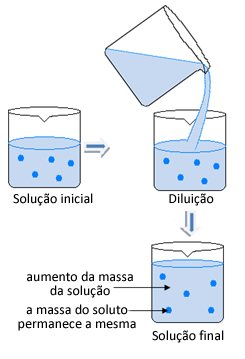
No entanto, a massa do solvente mudou e, consequentemente, a massa e a concentração da solução também mudaram. Tendo em vista que a fórmula da concentração comum é dada pela divisão entre a massa do soluto pelo volume da solução, temos o seguinte:
Cinicial = __m1__ Cfinal = __m1__
Vinicial Vfinal
m1 = Cinicial . Vinicial m1 = Cfinal . Vfinal
Cinicial . Vinicial = Cfinal . Vfinal
Por meio dessa relação é possível determinar a concentração da solução final. Veja um exemplo abaixo:
“500 mL de água foram adicionados a uma solução aquosa de ácido sulfúrico (H2SO4(aq)) de volume inicial igual a 200 mL e concentração de 20 g/L. Qual a concentração da solução após essa diluição?”
Resolução:
Dados:
Se a concentração inicial era de 20 g/L, isso significa que em cada litro da solução há 20 gramas de soluto (ácido sulfúrico) dissolvido. Assim, basta fazer uma regra de três para descobrir qual a massa do soluto que está dissolvida em 200 mL (0,2 mL) da solução:
20 g de ácido sulfúrico --------- 1 L de solução
m1 --------- 0,2 L
1 . m1 = 0,2 . 20
m1 = 4 g
Agora, para descobrir a concentração final basta usar a expressão abaixo:
Cinicial . Vinicial = Cfinal . Vfinal
(20 g/L) . 0,2 L = Cfinal . (0,2 L + 0,5 L)
Cfinal = _4g_
0,7L
Cfinal = 5,7 g/L
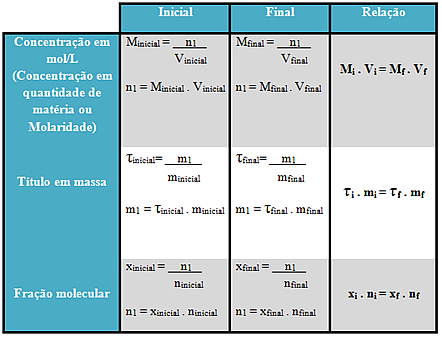
A mesma relação pode ser feita com a concentração em mol/L, com o título em massa e com a fração molecular, como mostra a tabela abaixo: