Molalidade de uma solução química
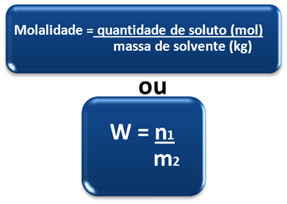
A Molalidade, normalmente representada pela letra W, é outra grandeza usada pelos químicos para expressar a concentração de uma solução. Ela pode ser definida da seguinte maneira:

Por isso, a molalidade também é chamada de concentração em quantidade de matéria por massa e essa relação pode ser expressa pela fórmula matemática:
Uma vez que n1 = m1/M1, podemos escrever também:

A unidade de molalidade é mols de soluto por kg de solvente (mol/kg ou mol . kg-1), mas ela é normalmente expressa pela palavra “molal” ou simplesmente “m”.
Essa grandeza é muito útil quando se trabalha com soluções cuja temperatura varia, visto que a temperatura pode fazer com que o volume mude e o cálculo da molalidade não precisa do volume. Além disso, essa medida de concentração é proveitosa quando se estuda os aspectos relacionados às propriedades coligativas, que dependem dos números relativos de moléculas de soluto e de solvente.
Outra informação importante é que experimentalmente se constata que no caso de soluções aquosas diluídas que contêm quantidade igual ou inferior a 0,1 mol de soluto por 1 litro de água, as concentrações expressas em molaridade (mol/L) e em molalidade (W) são aproximadamente iguais numericamente.
Os passos necessários para preparar uma solução com a molalidade especificada são simples: primeiro se medem as massas necessárias de soluto e de solvente; depois se dissolve o soluto no solvente.

Para entender como realizar os cálculos da molalidade, veja os exemplos a seguir:
Exemplo 1: “Para o preparo de uma solução, 0,5 mol de um sal foi dissolvido em 580 g de água. Vamos determinar então a concentração do soluto em mol por kg da solução.”
Para isso, podemos fazer o seguinte raciocínio:
0,58 kg (580g) de solvente dissolve 0,5 mol de soluto
1 kg de solvente dissolverá x
x = 1 kg . 0,5 mol
0,58 kg
x = 0,86 mol em 1 kg da solução = 0,86 mol/kg
Ou, então, podemos resolver essa questão substituindo os valores na fórmula da molalidade:
W = n1
m2
W = 0,5 mol
0,58 kg
W = 0,86 molal
Exemplo 2: “Qual é a molalidade da glicose num soro contendo 4 g de glicose (C6H12O6) em 100 g (0,1 kg) de água? Dado: massa molar da glicose = 180 g/mol.”
Primeiro precisamos calcular a quantidade de glicose, em mol:
1 mol -------- 180 g
X ------------- 4 g
x = 0,02 mol
Agora sim podemos calcular a molalidade da glicose no soro:
0,1 kg de água --------- 0,2 mol de glicose
1 kg ---------------------- y
y = 0,2 mol de glicose
A molalidade da glicose nesse soro é de 0,2 mol de glicose por quilograma de água.