Reações de oxirredução
As reações de oxirredução são aquelas em que há transferência de elétrons entre as espécies químicas envolvidas. Isso pode ser percebido por meio do número de oxidação (Nox) de cada elemento, que se trata da carga elétrica real, no caso de íons monoatômicos (um átomo que ganhou ou perdeu elétrons), e, no caso de compostos moleculares ou de íons polinuclerares, é a carga elétrica que ele teria se a ligação fosse rompida, ou seja, sua tendência de atrair os elétrons.
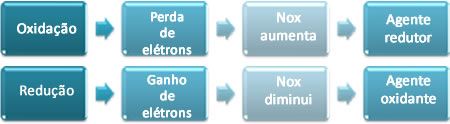
Assim, nós olhamos o Nox de cada elemento envolvido na reação e se percebermos que o seu Nox do reagente era menor que o do produto, isto é, aumentou, isso significa que ele perdeu elétrons na reação. Por outro lado, se o seu Nox no produto é menor, significando que ele diminuiu, quer dizer que essa espécie química ganhou elétrons.
Para entender melhor, vejamos um exemplo: Ao mergulhar uma fita de cobre metálico em uma solução de nitrato de prata, notamos que, com o passar do tempo, forma-se uma camada cinza sobre o cobre, e a solução, que inicialmente era incolor, vai ficando azul, como se pode ver na imagem abaixo:

Precipitação de prata em cobre a partir de uma solução de nitrato de prata*
A cor azul deve-se à formação de cátions cobre (Cu2+) que ficam dissolvidos na solução. Isso significa que o cobre metálico (Cu0) perdeu elétrons para se transformar nesse cátion. Dessa forma, dizemos que ele sofreu uma oxidação. Acompanhe a seguir:
Oxidação → Perda de elétrons → Nox aumenta: Cu0(s) → Cu2+(aq) + 2 e-
Ao mesmo tempo, os íons prata (Ag+) que existiam na solução de nitrato de prata (AgNO3) receberam esses elétrons que o cobre perdeu e transformaram-se em prata metálica (Ag0), que se depositou na fita de cobre. Isso significa que os íons prata sofreram redução:
Redução → Ganho de elétrons → Nox diminui: 2 Ag+(aq) + 2e-→ 2 Ag0(s)
Visto que houve transferência de elétrons, com ocorrência simultânea de oxidação e de redução, esse é um exemplo de reação de oxirredução, que é dada pela soma das duas semirreações acima:
Reação de oxirredução: Cu(s) + 2 AgNO3(aq) → Cu(NO3)2(aq) + 2 Ag(s)
Outros dois conceitos importantes nas reações de oxirredução são “agente oxidante” e “agente redutor”. Como os próprios nomes dizem, o agente oxidante é o que causa a oxidação de outra espécie química, enquanto o agente redutor é o que provoca a redução da outra.
No exemplo mencionado, o cobre metálico perdeu elétrons, ou seja, ele doou esses elétrons para o cátion prata, causando a sua redução. Portanto, o cobre é o agente redutor. Por outro lado, os cátions prata da solução de nitrato de prata foram os que receberam os elétrons do cobre, causando a oxidação dele. Por isso, o nitrato de prata (e não o cátion prata) é o agente oxidante.
Observação importante: Note que a substância redutora é a que contém o átomo que forneceu os elétrons e a substância oxidante é a que contém o átomo que recebeu os elétrons. Assim, lembre-se de que os agentes oxidante e redutor não são os átomos isolados, mas as substancias que os contêm.
Resumidamente, temos:
* Créditos das imagens:
Autor: Toby Hudson / Fonte de onde foi extraída: Wikimedia Commons: http://commons.wikimedia.org/wiki/File:Precipitation_of_Silver_on_Copper_1.jpg?uselang=pt- e br http://commons.wikimedia.org/wiki/File:Precipitation_of_Silver_on_Copper_2.jpg?uselang=pt-br

