Séries dos lantanídeos e actinídeos
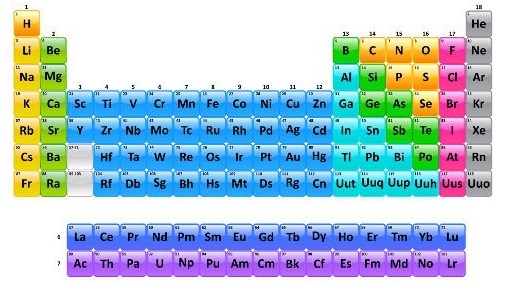
As séries dos lantanídeos e dos actinídeos correspondem, respectivamente, ao sexto e sétimo períodos da família IIIB da Tabela Periódica. Estão posicionadas sempre do lado de fora do corpo principal da Tabela porque possuem um grande número de elementos. Cada uma das séries apresenta quinze elementos químicos.
Os elementos químicos pertencentes à série dos lantanídeos são:
- Lantânio (La), Cério (Ce), Praseodímio (Pr), Neodímio (Nd), Promécio (Pm), Samário (Sm), Európio (Eu), Gadolínio (Gd), Térbio (Te), Disprósio (Dy), Hólmio (Ho), Érbio (Er), Túlio (Tm), Itérbio (Yb) e o Lutécio (Lu).
Já os elementos pertencentes à série dos actinídeos são:
- Actínio (Ac), Tório (Th), Protactínio (Pa), Urânio (U), Netúnio (Np), Plutônio (Pu), Amerício (Am), Cúrio (Cm), Berquélio (Bk), Califórnio (Cf), Einstênio (Es), Férmio (Fm), Mendelévio (Md), Nobélio (No) e o Laurêncio (Lw).
Em virtude da quantidade de elementos químicos presente nas duas séries, a família IIIB é a que apresenta a maior quantidade de elementos químicos da Tabela, mais especificamente, 32 elementos.
De uma forma geral, as características físicas e químicas dos elementos pertencentes às séries dos lantanídeos e actinídeos são:
- Todos os elementos das duas séries são sólidos em temperatura ambiente;
- Todos os elementos das séries são metais;
- Com exceção do elemento Promécio, todos os elementos da série dos lantanídeos são naturais;
- Todos os elementos da série dos actinídeos são radioativos;
- Com exceção dos elementos Actínio, Tório, Protactínio e Urânio, todos os elementos da série dos actinídeos são artificiais.
De todos os elementos químicos que pertencem à série dos lantanídios e actinídeos, apenas dois deles possuem como subnível mais energético o subnível d1. Veja quais são esses elementos e suas respectivas distribuições eletrônicas:
- Lutécio

- Laurêncio

Todos os outros elementos pertencentes à série dos lantanídios e actinídeos possuem como subnível mais energético o subnível f. No caso dos lantanídeos (sexto período), todos eles possuem como subnível mais energético o 4f. Já os actinídeos (sétimo período) possuem como subnível mais energético o 5f. Em todos os casos, o diferencial é apenas o número de elétrons no f, o qual corresponde exatamente à posição ocupada pelo elemento na série, ou seja, se f2, o elemento será o segundo da série e assim por diante. Acompanhe os exemplos:
Exemplos de distribuições eletrônicas de lantanídeos:
- Samário

- Hólmio

Exemplos de distribuições eletrônicas de lantanídeos:
- Protactínio

- Califórnio
Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias


















