Períodos e famílias da tabela periódica
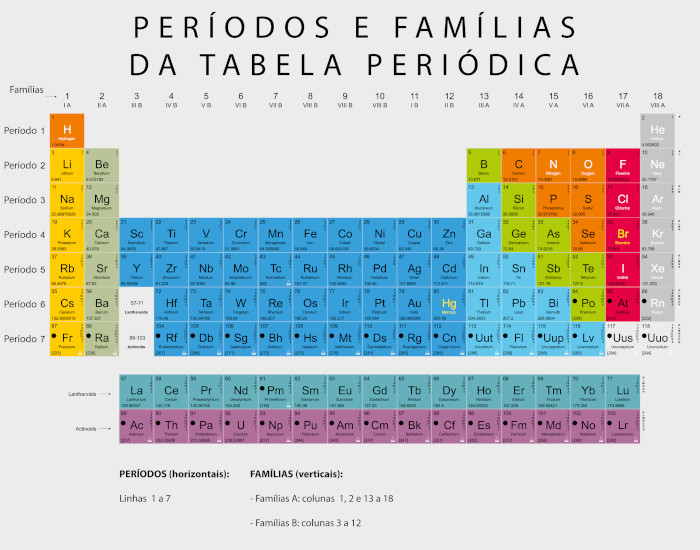
Os períodos e famílias da tabela periódica são as linhas e colunas que servem para sistematizar a organização dos elementos químicos de acordo com suas propriedades e características comuns. Nesse sentido, enquanto os períodos servem para indicar o número de camadas eletrônicas dos átomos dos respectivos elementos, as famílias (denominação antiga) indicam quantos elétrons existem na camada de valência atômica desses elementos. Os períodos da tabela periódica são 7 linhas horizontais, que não têm um nome específico, e as famílias são 18 colunas, divididas em 2 grupos: família A e família B.
Leia também: Propriedades dos elementos químicos — periódicas e aperiódicas
Resumo sobre períodos e família da tabela periódica
- Os períodos e famílias da tabela periódica são as linhas horizontais e verticais que servem para organizar os elementos químicos.
- Os períodos são ao todo 7 linhas horizontais e representam o aumento sequencial de camadas eletrônicas.
- As famílias são organizadas em 18 colunas verticais.
- As famílias de IA a VIIIA (grupos 1 e 2 e 13 a 18) têm nomes específicos e são conhecidas como elementos representativos.
- À medida que se percorrem os períodos e famílias, há um aumento ou redução das propriedades periódicas dos elementos.
O que são períodos e famílias da tabela periódica?
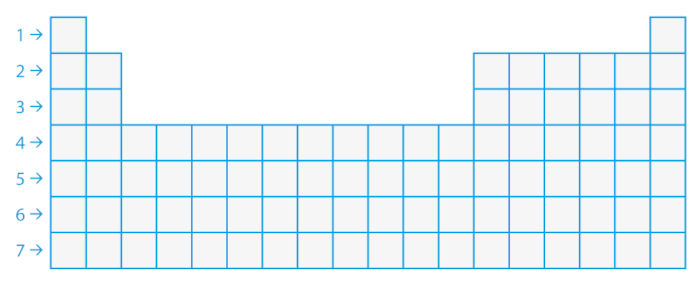
Os períodos são as linhas horizontais da tabela, sendo sete no total, e representam o número de camadas eletrônicas presentes nos átomos dos elementos.
As famílias (grupos), por sua vez, são as colunas verticais da tabela, que indicam a quantidade de elétrons presentes na camada de valência dos átomos dos elementos.
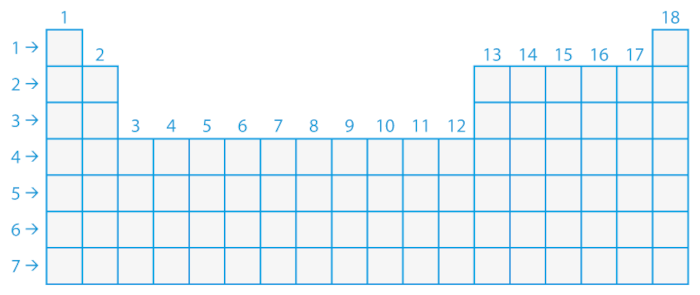
Organização dos períodos e famílias na tabela periódica
A organização dos períodos e famílias segue um padrão sistemático de fácil compreensão. Como foi falado anteriormente, os períodos representam o número de camadas eletrônicas que um elemento tem em seu átomo. Por exemplo, o primeiro período contém os elementos que têm apenas uma camada de elétrons, enquanto o segundo contém elementos com duas camadas de elétrons, e assim por diante.
Para facilitar sua compreensão, veja, na tabela abaixo, a organização dos períodos dispostos na horizontal:
Já as famílias são organizadas de acordo com a quantidade de elétrons presentes na camada de valência (última camada eletrônica do átomo) de cada elemento. Essa camada é responsável pelas propriedades químicas desses elementos. Na tabela anterior, é possível visualizar as colunas verticais representando as famílias A e B e seus respectivos grupos correspondentes.
Veja também: Metais — características, tipos e distribuição na tabela periódica
Quais são os períodos da tabela periódica?
Os períodos não possuem nomes específicos, são individualizados apenas pelos números que indicam a quantidade de camadas eletrônicas que cada átomo tem. Sendo assim, por exemplo, todos os elementos do 4º período possuem quatro camadas eletrônicas em seus átomos, do potássio (K) ao criptônio (Kr), conforme pode ser visto na tabela abaixo:
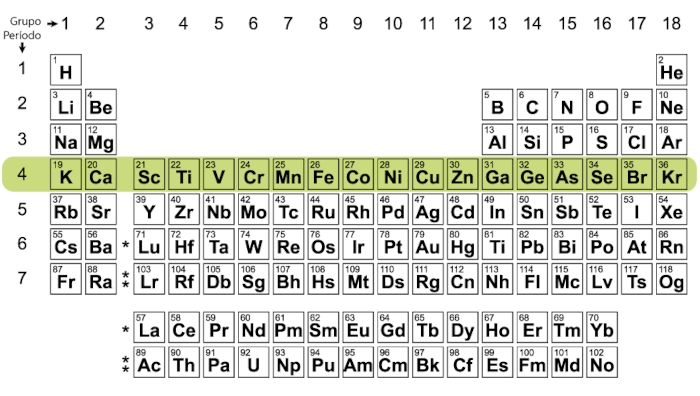
De modo análogo, ao pegarmos o primeiro e o último elemento de cada período, teremos a seguinte disposição:
- Período 1: H – He (do hidrogênio ao hélio);
- Período 2: Li – Ne (do lítio ao neônio);
- Período 3: Na – Ar (do sódio ao argônio);
- Período 4: K – Kr (do potássio ao criptônio);
- Período 5: Rb – Xe (do rubídio ao xenônio);
- Período 6: Cs – Rn (do césio ao radônio);
- Período 7: Fr – Og (do frâncio ao oganessônio).
Quais são as famílias da tabela periódica?
As famílias da tabela periódica são divididas em dois grandes grupos (A e B) e referem-se a duas categorias diferentes de grupos (ou colunas) que organizam os elementos com base em suas propriedades químicas e comportamentos, conforme pode ser visualizado na imagem abaixo:
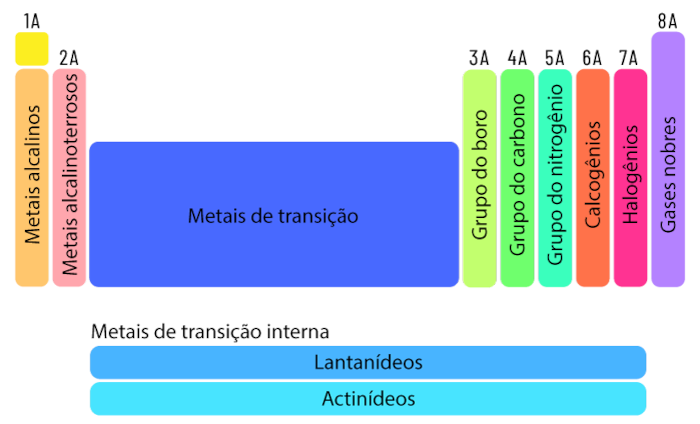
Perceba que as famílias A geralmente incluem os grupos principais (1, 2 e de 13 a 18), também conhecidos como grupos representativos, em que cada um deles também recebe um nome característico:
|
Famílias A da Tabela Periódica |
|
|
Família IA |
Metais alcalinos |
|
Família IIA |
|
|
Família IIIA |
Grupo do boro |
|
Família IVA |
Grupo do carbono |
|
Família VA |
Grupo do nitrogênio |
|
Família VIA |
Calcogênios |
|
Família VIIA |
Halogênios |
|
Família VIIIA |
Gases nobres |
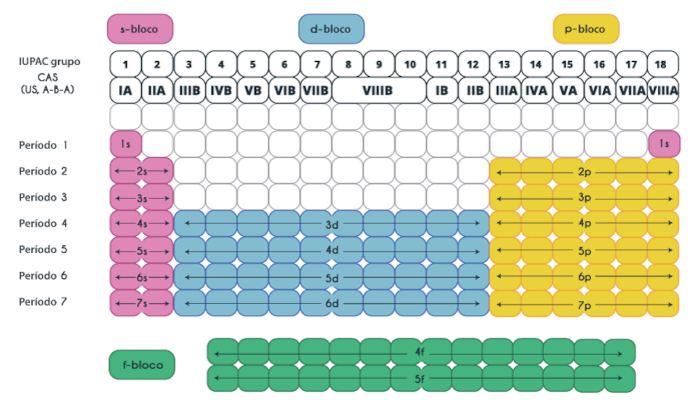
Já as famílias B, frequentemente chamadas de blocos de transição, incluem os grupos de 3 a 12 na tabela periódica. Também podem ser chamadas de elementos de transição (ou metais de transição), como ferro, cobre, zinco, níquel, etc.
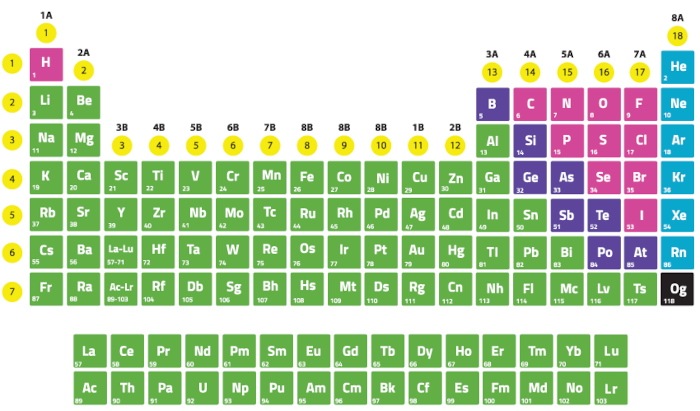
Além disso, os elementos nas famílias B são geralmente caracterizados por suas propriedades metálicas e pela presença de elétrons de transição. Sendo assim, eles têm camadas eletrônicas internas e externas que contribuem para suas propriedades variadas.
Características dos períodos e famílias da tabela periódica
→ Características dos períodos da tabela periódica
Cada período começa com um átomo que tem apenas um nível de energia e, à medida que você se move de um período para o próximo na tabela periódica, está adicionando uma camada de elétrons ao redor dos átomos, o que influencia as características de cada período e, consequentemente, as propriedades dos elementos. Nesse contexto, podemos destacar algumas características importantes dos períodos:
- Cada período representa um aumento na energia dos elétrons e na distância deles do núcleo do átomo.
- Cada período começa com o elemento que tem o menor número atômico para aquela camada específica.
- Os elementos são organizados na tabela periódica em ordem crescente de número atômico (da esquerda para a direita nos períodos).
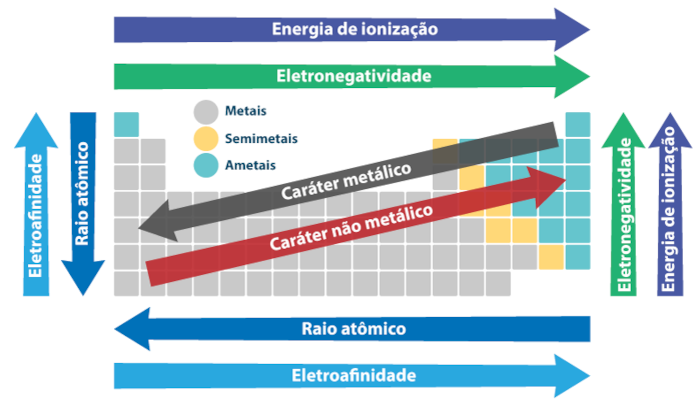
Dessa forma, as propriedades dos elementos mudam de maneira regular ao longo de um período, algo que é denominado periodicidade ou propriedade periódica, como pode ser visualizado na imagem abaixo. Alguns elementos não se encaixam perfeitamente nas tendências gerais de seus períodos ou grupos, o que pode ser atribuído a configurações eletrônicas.
→ Características das famílias da tabela periódica
De modo semelhante aos períodos, elementos de uma mesma família têm propriedades químicas parecidas. Isso ocorre porque os átomos desses elementos têm o mesmo número de elétrons na camada mais externa, o que influencia fortemente seu comportamento químico.
Logo, enquanto você se move de cima para baixo em um grupo, as propriedades físicas e químicas tendem a mudar de maneira previsível. Por exemplo, o raio atômico geralmente aumenta e a eletronegatividade diminui à medida que você desce em um grupo.
Sendo assim, podemos resumir da seguinte forma:
- Raio atômico: aumenta da direita para a esquerda em um período e de cima para baixo em grupo.
- Eletronegatividade, eletroafinidade e energia de ionização: aumentam da esquerda para a direita em um período e de baixo para cima em um grupo.
Quanto ao caráter metálico e não metálico, ele não obedece ao mesmo padrão anterior.
Saiba mais: Ametais — elementos com características opostas às dos metais
Exercícios resolvidos sobre períodos e famílias da tabela periódica
1. Em um experimento laboratorial, um cientista observou que um elemento reagiu de forma bastante vigorosa com os halogênios. Qual família da tabela periódica contém esses elementos com os quais o elemento em questão reagiu intensamente?
a) Família IA (metais alcalinos)
b) Família IVA (carbono)
c) Família VIIA (halogênios)
d) Família IIA (metais alcalinoterrosos)
e) Família VIA (calcogênios)
Gabarito: Letra C. Os halogênios estão localizados no Grupo 17 (Família VIIA).
2. Um pesquisador está analisando um conjunto de elementos e observa que todos têm a propriedade de serem bons condutores de eletricidade, possuírem alta maleabilidade e ductilidade e formarem íons positivos facilmente. Com base nessas observações, a que grupo da tabela periódica esses elementos provavelmente pertencem?
a) Grupo 2 (Metais alcalinoterrosos)
b) Grupo 14 (carbono)
c) Grupo 18 (gases nobres)
d) Grupo 17 (halogênios)
e) Grupo 13 (boro)
Gabarito: Letra A. Os elementos do grupo 2 (família IIA) são caracterizados por serem metais alcalinoterrosos, que têm as propriedades mencionadas. Outro detalhe é que somente metais poderiam ter essas características, e o próprio nome do grupo já indica isso.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. A periodicidade. In: Princípios de Química: Questionando A Vida Moderna e o Meio Ambiente. 7. ed. [s.l.] Bookman, 2018. p. 51–63.
DE BARROS FARIA, R. The periodic table. Its story and its significance. Quimica Nova, 2009.
L. BROWN, T. et al. Tabela periódica. In: Química: A Ciência Central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 54–57.
SCERRI, E. R. The Evolution of the Periodic System. Scientific American, v. 279, n. 3, p. 78–83, 1998.
Ferramentas Brasil Escola

Artigos Relacionados

Últimas notícias
Outras matérias


















