Temperatura de ebulição dos compostos orgânicos
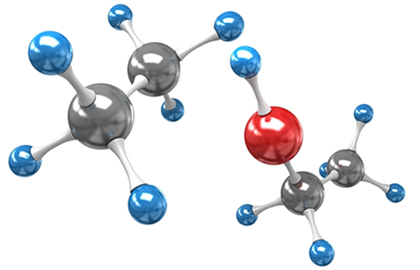
Existem três fatores principais que interferem na temperatura de ebulição dos compostos orgânicos, que são: o tipo de interação intermolecular, a polaridade e o tamanho da molécula.
- Polaridade e tipo de interação intermolecular:
Esses dois fatores estão intimamente relacionados, pois a polaridade da molécula define o tipo de interação intermolecular que haverá. Por exemplo, os hidrocarbonetos são compostos orgânicos que possuem somente átomos de carbono e hidrogênio, cuja eletronegatividade (força de atração do par de elétrons compartilhado) é praticamente a mesma, ou seja, podemos dizer que praticamente não há diferença de eletronegatividade entre esses átomos e essas moléculas são apolares.
Desse modo, essas moléculas são atraídas umas às outras pelo tipo de interação intermolecular mais fraco (dipolo induzido).
As demais funções orgânicas, tais como os álcoois, as cetonas, as aminas, as amidas, os aldeídos e os ácidos carboxílicos, possuem átomos de elementos com a eletronegatividade mais acentuada (oxigênio e nitrogênio). Assim, tais moléculas são polares e a intensidade da força de atração entre elas é maior; elas realizam ligações de hidrogênio.
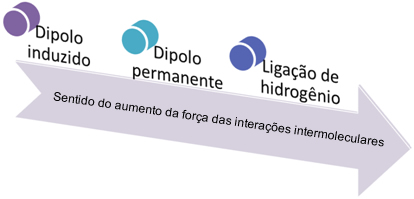
Por exemplo, os álcoois possuem o grupo funcional OH, realizando ligações de hidrogênio entre suas moléculas, em que o oxigênio de uma se liga ao hidrogênio de outra e assim sucessivamente, ou seja, as atrações entre suas moléculas são fortes.
Os hidrocarbonetos possuem o ponto de ebulição menor que os álcoois. Um exemplo é o etano (H3C _ CH3 – hidrocarboneto) e o etanol (H3C _ CH2 _ OH – álcool), cujos pontos de ebulição são, respectivamente, -88,4 ºC e 78,5ºC.
Isso acontece porque a mudança de estado físico corresponde ao rompimento das forças intermoleculares. Desse modo, quanto maior for a intensidade das forças intermoleculares, mais difícil será para rompê-las, mais energia será necessária e, consequentemente, maior será a temperatura de ebulição.
- Tamanho da molécula:
Quanto maior o tamanho da molécula, maior será o ponto de ebulição.
Por exemplo, o etano e o butano são ambos alcanos, mas a massa molar do etano é igual a 30 g/mol e seu ponto de ebulição é -88ºC, enquanto o butano tem massa molar maior (58g/mol) e ponto de ebulição maior também (0,5 ºC).
Isso acontece porque se a molécula possui maior superfície, isso levará a um maior número de interações intermoleculares e, portanto, será necessária uma maior quantidade de energia para desfazê-las.
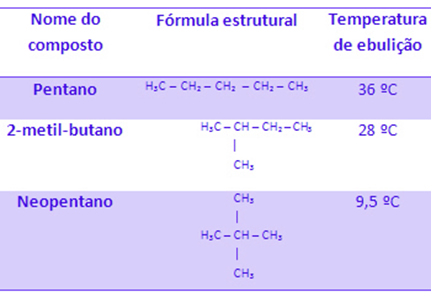
Além disso, quanto maior a quantidade de ramificações, menor será a temperatura de ebulição.
Veja isso no exemplo abaixo em que a fórmula molecular de todos os compostos mostrados é a mesma (C5H12), mas as suas temperaturas de ebulição são diferentes graças à diferença na quantidade de ramificações:
Ferramentas Brasil Escola


Últimas notícias
Outras matérias



















