Tonoscopia ou Tonometria
Ao adicionarmos um soluto não volátil a um solvente puro, sem alterarmos sua temperatura, notaremos que haverá um abaixamento da pressão de vapor do solvente. Ao estudo desse fenômeno é dado o nome de Tonoscopia ou Tonometria. Por exemplo, quando se adiciona açúcar à água, a pressão de vapor da água diminui.
A pressão de vapor da solução formada sempre será menor que a do solvente puro em razão do solvente e do soluto não volátil realizarem interações intermoleculares, o que dificulta a passagem das moléculas do solvente para o estado de vapor.
Para entender melhor, pense no seguinte: na água – um líquido puro – a evaporação ocorre quando eventualmente uma de suas moléculas ganha energia suficiente para romper as ligações intermoleculares, que, no caso, são as ligações de hidrogênio, escapando assim para fora da massa líquida. Se dissolvermos açúcar na água, ocorrerão interações também com as moléculas de açúcar, o que dificultará ainda mais a passagem das moléculas para o estado de vapor.
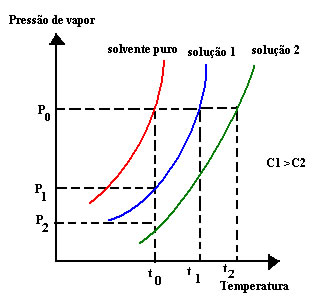
Um aspecto importante a ser ressaltado é que o valor deste abaixamento da pressão de vapor dependerá da concentração do soluto não volátil que foi dissolvido e da temperatura considerada. Quanto maior a concentração de soluto dissolvido, maior será o abaixamento da pressão de vapor do solvente. Além disso, soluções de mesmo solvente com solutos diferentes, mas com a mesma concentração, terão pressões de vapor iguais. Por exemplo, considere duas soluções: a primeira de água e sacarose e a segunda de água e glicose. Se as duas soluções tiverem a mesma concentração, suas pressões de vapor também serão iguais, independente do soluto dissolvido.
No entanto, vale salientar que ocorre uma exceção quando o soluto se ioniza completamente, como é o caso de uma solução de Cloreto de Sódio (NaCl – sal de cozinha). Neste caso, a concentração será duplicada em relação aos outros solventes, porque teremos dissolvidos íons de sódio (Na+) e íons cloreto (Cl-).
Outro ponto é que quanto maior a temperatura do sistema, maior será a pressão de vapor. Estas relações da concentração e da temperatura com a pressão de vapor são demonstradas no gráfico abaixo: