Distribuição eletrônica e a Tabela Periódica

A Tabela Periódica organiza os elementos químicos em ordem crescente de número atômico. Muitas informações sobre os átomos que formam esses elementos podem ser retiradas dela. Para isso, basta conhecer bem a sua organização e saber realizar a distribuição eletrônica no diagrama de Linus Pauling. Resumindo: existe uma grande relação entre a distribuição eletrônica e a Tabela periódica.
A Tabela Periódica é organizada da seguinte forma:
-
Colunas Verticais: são as chamadas famílias (divididas em A e B, sendo oito de cada) ou grupos (numerados de 1 a 18);
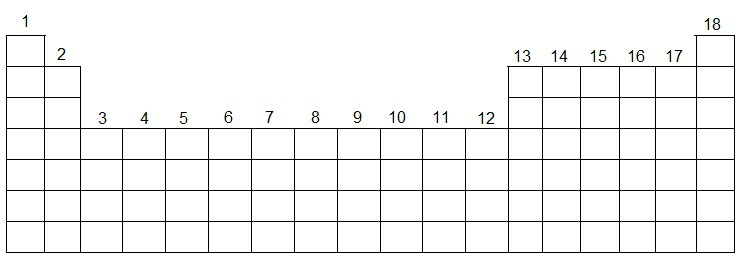
Os grupos (ou famílias) da Tabela são numerados da esquerda para a direita de 1 a 18
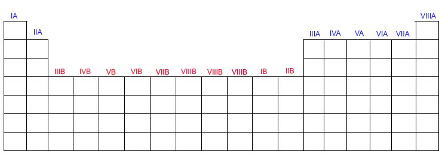
Os grupos (ou famílias) na tabela são divididas em A ou B
-
Colunas Horizontais: são os chamados períodos. Ao todo na tabela, eles são sete.
A Tabela periódica apresenta um total de sete períodos
Observação: As séries dos Lantanídeos e dos Actinídeos (pertencentes à família IIIB), posicionadas fora e abaixo da tabela, pertencem, respectivamente, ao sexto e sétimo períodos.
Os lantanídeos pertencem ao 6o período, e os actinídeos, ao 7o
O diagrama de Linus Pauling é composto por níveis (um total de sete) e subníveis (s, p, d, f) que são organizados da seguinte forma:
Diagrama de Linus Pauling (as setas indicam ordem de energia)
As setas em vermelho e rosa indicam a ordem de energia que devemos seguir para realizar a distribuição eletrônica. A seta vermelha que passa pelo 1s é o local de menor energia; e a seta rosa, que passa por 5f, 6d e 7p, é o local de maior energia. Assim, se formos realizar a distribuição de 20 elétrons, devemos seguir a seguinte sequência:
Podemos observar que a distribuição eletrônica terminou no subnível 4s, o que o torna o subnível mais energético do átomo com 20 elétrons. Além disso, notamos que, como a distribuição passou por quatro níveis de energia, esse átomo apresenta quatro níveis. O mais interessante é que podemos obter essas duas informações apenas avaliando a tabela periódica, basta analisar as famílias e períodos.
A partir do período, nós conseguimos determinar o número de níveis de um átomo de qualquer elemento. O subnível mais energético e o número de elétrons podem ser identificados facilmente pela família. Para isso, basta seguir o esquema organizacional abaixo que mostra o subnível em cada área do diagrama e o número de elétrons que haverá em cada caso:
Distribuição dos subníveis aplicada em cada uma das famílias
Assim fica muito simples determinarmos o número de níveis e o subnível de maior energia de qualquer elemento químico. Veja alguns exemplos:
Tabela periódica dos elementos químicos
1º) Na (Família IA, 3o período)
Como o sódio (Na) está na Família IA e no 3º Período, seu subnível mais energético é s1 e o átomo apresenta três níveis. Resumindo: 3s1 seria o término da sua distribuição.
2º) Hg (Família IIB, 6o período)
Como o mercurio (Hg) é da família IIB e está no sexto período, seu subnível mais energético é o d10 e apresenta quatro níveis. Todavia, sempre que estivermos trabalhando com um elemento de subnível d, sua distribuição sempre terminará em um nível anterior. Isso ocorre porque, seguindo a ordem de energia do diagrama de Linus Pauling, para terminar em d, antes passamos pelo s do nível seguinte. Resumindo: a distribuição do cobre termina em 5d10.
3º) Nd (Família IIIB, 6o período / série dos actinídeos)
Como o Neodímio (Nd) é o quarto elemento da série dos actinídeos e está no sexto período, seu subnível mais energético é o f4 e apresenta seis níveis. Todavia, sempre que estivermos trabalhando com um elemento de subnível f, sua distribuição sempre terminará em dois níveis anteriores. Isso ocorre porque, seguindo a ordem de energia do diagrama de Linus Pauling, para terminar em f, antes passamos pelo s de dois níveis seguintes. Resumindo: a distribuição do neodímio termina em 4f4.
4º) Bk (Família IIIB, 7o período /série dos lantanídeos)
Como o Berquélio (Bk) é o nono elemento da série dos actinídeos e está no sétimo período, seu subnível mais energético é o f9 e apresenta sete níveis. Como já esclarecido no item anterior, por apresentar subnível f, sua distribuição terminará em dois níveis anteriores. Resumindo: a distribuição do berquélio termina em 5f9.



