Distribuição Eletrônica no Diagrama de Pauling
Segundo o cientista Schrödinger, cada elétron da eletrosfera de um átomo possui uma determinada quantidade de energia. Assim, cada elétron só permanece no nível e subnível de energia correspondente.
A distribuição desses elétrons em seus níveis e subníveis de energia é feita de forma crescente de energia. E sua representação gráfica é dada pelo Diagrama de Pauling, criado pelo químico Linus Pauling (1901-1994), que recebeu dois prêmios Nobel, um de Química (1954) e o outro da Paz (1962).
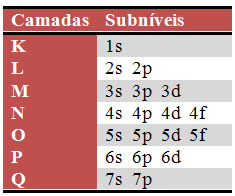
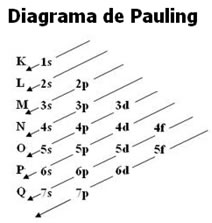
O diagrama de Pauling representa os níveis, que são as camadas eletrônicas do átomo. São sete níveis, enumerados de forma crescente do mais próximo ao núcleo para fora (1, 2, 3... 7) e, denominados, respectivamente, pelas letras K, L, M, N, O, P e Q.
Existem no máximo quatro subníveis, que são: s, p, d, f.
A quantidade de subníveis existentes em cada nível está esboçada abaixo:
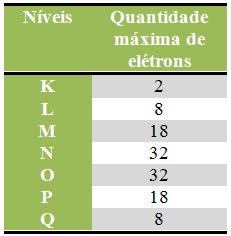
A quantidade máxima de elétrons que pode ser distribuída em cada nível e subnível está evidenciada a seguir:
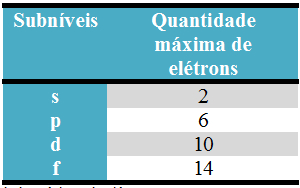
Visto que, para um mesmo nível, os subníveis têm energias diferentes, nem sempre o subnível energético é o mais afastado do núcleo. Por isso, é importante seguir a ordem crescente de energia dos subníveis no momento de fazer a distribuição dos elétrons. Essa ordem é dada pelas setas indicadoras no Diagrama de Pauling:
Portanto, veja exemplos de distribuição dos elétrons de dois elementos químicos:
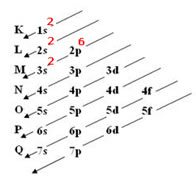
Exemplo 1: Magnésio (12Mg)
Ordem energética da distribuição eletrônica do 12Mg: 1s2, 2s2, 2p6 e 3s2.
Exemplo 2: Vanádio (23V):
Ordem energética da distribuição eletrônica do 23V: 1s2, 2s2, 2p6,3s2, 3p6, 4s2 e 3d3.
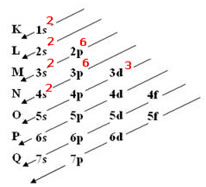
Observe que, nesse exemplo, no último subnível preenchido (3d) cabiam 10 elétrons; porém, apenas 3 foram necessários para completar o número atômico.