Eletrólise da água
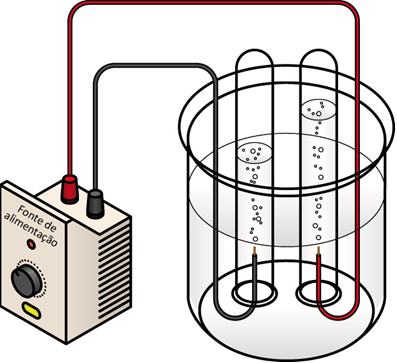
No texto “Eletrólise em meio aquoso” foi mostrado que esse processo ocorre quando há uma passagem de corrente elétrica numa solução aquosa, isto é, com um sal, um ácido ou uma base, dissolvidos em água e que se ionizam ou sofrem dissociação iônica, originando íons livres.
Os íons da água interferem nas eletrólises em meio aquoso, porque eles podem se depositar nos eletrodos se a sua tendência for maior do que a dos íons da substância dissolvida.
Quando está na sua forma pura, porém, a água (destilada) é má condutora de eletricidade e não é possível realizar a sua decomposição eletrolítica. Isso acontece porque a autoionização da água é muito pequena e insuficiente para conduzir corrente elétrica.
Então, se quisermos causar uma eletrólise do cátion e do ânion da água, teremos que dissolver algum soluto que contenha íons mais reativos que os da água, que não participem das reações envolvidas. Através da lista de prioridade de descarga dos íons em solução aquosa, que está logo abaixo, é possível saber quais são os cátions mais reativos que o hidrônio (H3O+) e que ânions são mais reativos que a hidroxila (OH-):
.jpg)
Observe que os cátions dos metais alcalinos, dos metais alcalinoterrosos e do alumínio têm menor facilidade de descarga que o hidrônio (H3O+) e que os ânions oxigenados e o fluoreto têm menor facilidade de descarga que a hidroxila (OH-).
Assim, algumas substâncias que podem ser usadas são:
- Ácido sulfúrico, H2SO4, cujo ânion SO2-4 é mais reativo que o OH- da água, e o cátion é o mesmo que o da água, (H+);
- Hidróxido de sódio, NaOH, em que o cátion Na+ é mais reativo que o cátion H+ da água, e o ânion é o mesmo que o dela (OH-);
- Nitrato de potássio, KNO3, sendo que seu cátion K+ é mais reativo que o cátion H+ da água, e o ânion NO-3 é mais reativo que o OH- da água.
Veja um exemplo em que a substância dissolvida na água é o sal sulfato de sódio, Na2SO4. Nesse caso, temos em solução os íons provenientes da dissociação do sal e da ionização da água:
Dissociação do sal: 1 Na2SO4 → 2 Na+ + 1 SO2-4
Ionização da água: 8 H2O → 4 H3O+ + 4 OH-
Conforme se pode verificar na tabela de prioridade de descarga de íons em solução aquosa, o cátion Na+ do sulfato de sódio tem menor facilidade de descarga que o cátion H+ da água, e o ânion SO2-4 tem menor facilidade de descarga que o OH- da água. Assim, o H+ da água sofre redução no eletrodo negativo (cátodo) e produz gás hidrogênio, H2. Enquanto isso, o ânion OH- da água sofre oxidação no eletrodo positivo (ânodo), produzindo gás oxigênio, O2:
Semirreação do cátodo: 4 H3O+ + 4 e- → H2O + H2
Semirreação do ânodo: 4 OH- → 2 H2O + 1 O2 + 4 e-
Somando-se todo esse processo, chegamos à equação global:
Dissociação do sal: 1 Na2SO4 → 2 Na+ + 1 SO2-4
Ionização da água: 8 H2O → 4 H3O+ + 4 OH-
Semirreação do cátodo: 4 H3O+ + 4 e- → 4 H2O + 2 H2
Semirreação do ânodo: 4 OH- → 2 H2O + 1 O2 + 4 e-
Equação global: 2 H2O → 2 H2 + 1 O2
Não se escreve a fórmula do sal na equação global porque ele não participou da reação, seus íons continuam livres em água na mesma concentração inicial. O sal serviu apenas para ajudar na condução de corrente elétrica e efetivar a eletrólise da água.
Observe que o volume de gás hidrogênio produzido é o dobro do volume de gás oxigênio, o que está de acordo com a fórmula da água, que apresenta a proporção entre esses átomos de 2 : 1, respectivamente. Por isso, é possível saber qual gás está sendo borbulhado em cada eletrodo.



