Pilhas
Pilhas são dispositivos que transformam energia química em elétrica por meio de reações de oxirredução. Também conhecidas como celas (ou células) galvânicas ou até mesmo “voltaicas”, as pilhas são objetos de estudo da eletroquímica, bem como uma forma de garantir energia elétrica portátil. Desde para o controle remoto da televisão até para brinquedos, relógios e lanternas, esses pequenos dispositivos fornecem energia elétrica de maneira prática e eficiente.
Mas o que realmente acontece dentro de uma pilha para que ela consiga transformar energia química em eletricidade? Bem, o funcionamento delas é baseado em reações de oxirredução que geram um fluxo contínuo de elétrons, permitindo o funcionamento de diversos aparelhos. Portanto, entender esse processo não só ajuda a compreender sua importância como também a fazer escolhas mais eficientes no dia a dia, como optar por pilhas recarregáveis ou descartar corretamente as usadas.
Leia também: O que são baterias?
Resumo sobre pilhas
- Pilhas são dispositivos que convertem energia química em elétrica por meio de reações de oxirredução espontâneas.
- São compostas por dois eletrodos (ânodo e cátodo) e um eletrólito, que permite a movimentação de íons para manter o equilíbrio de cargas.
- No ânodo ocorre a oxidação, liberando elétrons, enquanto no cátodo ocorre a redução, consumindo esses elétrons.
- Os elétrons se deslocam pelo circuito externo, gerando corrente elétrica até que os reagentes se esgotem.
- Podem ser classificadas em pilhas primárias (descartáveis) e secundárias (recarregáveis).
- Pilhas AA e AAA têm a mesma voltagem, mas diferem no tamanho e na capacidade de carga, sendo as AA mais duráveis.
- A pilha de Daniell é um exemplo clássico e utiliza zinco e cobre como eletrodos.
- A diferença entre pilhas e baterias está na organização: as pilhas são unidades individuais, enquanto as baterias são compostas por múltiplas pilhas conectadas para fornecer maior energia.
Videoaula sobre pilhas
O que são pilhas?
Pilhas são dispositivos que convertem energia química em energia elétrica por meio de reações de oxirredução espontâneas. De modo geral, elas têm dois eletrodos, ânodo e cátodo, mergulhados em soluções eletrolíticas, em que ocorre a transferência de elétrons. Caso ocorresse o processo inverso, isto é, a transferência de eletricidade de uma fonte externa para forçar uma reação química, teríamos um processo de eletrólise.
Funcionamento das pilhas
O funcionamento das pilhas baseia-se em reações químicas de oxirredução que geram corrente elétrica. Desse modo, enquanto no ânodo (polo negativo) ocorre a oxidação por meio da liberação de elétrons, no cátodo (polo positivo) acontece a redução, consumindo esses elétrons. Assim os elétrons se deslocam do ânodo para o cátodo por meio de um circuito externo, produzindo eletricidade, que pode ser utilizada para alimentar circuitos e dispositivos eletrônicos, conforme é ilustrado a seguir:
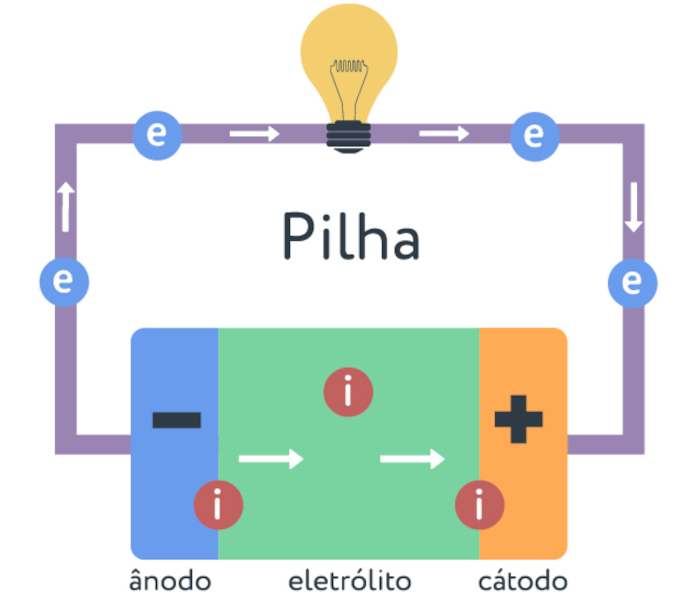
Para manter o equilíbrio de cargas, íons se movimentam através do eletrólito ou de uma ponte salina, dependendo do tipo de pilha, e, assim, esse processo continua até que os reagentes se esgotem e a pilha deixe de gerar energia.
Quimicamente a representação de uma pilha segue a notação eletroquímica, a qual indica os eletrodos, os íons envolvidos e o sentido das reações. No caso da famosa pilha de Daniell (Zn/Cu), a notação é:
Zn(s) | Zn2+(aq) || Cu2+(aq) | Cu(s)
Em que:
- O ânodo é representado à esquerda: Zn(s) | Zn2+(aq)
- A ponte salina é indicada pelo símbolo: ||
- O cátodo é representado à direita: Cu2+(aq) | Cu(s)
Essa notação segue o sentido do fluxo de elétrons no circuito externo (do ânodo para o cátodo) e indica a ordem das reações que ocorrem na pilha.
Veja também: O que é eletrólise?
Pilhas são células primárias ou secundárias?

Primeiro vamos entender dois conceitos importantes que são o de células primárias e o de células secundárias. As células primárias não podem ser recarregadas, pois suas reações químicas são irreversíveis. Um bom exemplo disso é a pilha alcalina, bastante usada em controles remotos, lanternas e brinquedos. As células secundárias, por outro lado, são recarregáveis, porquanto suas reações químicas podem ser revertidas ao aplicar-se uma corrente elétrica externa. Um exemplo clássico disso é a bateria de íons de lítio, presente em celulares e notebooks.
Em vista disso, entende-se que as pilhas são, em sua essência, células primárias, ou seja, não recarregáveis; logo, na prática, não existe “pilha secundária”, o correto é bateria recarregável, como as de celulares ou notebooks.

Agora que entendemos que as pilhas são células primárias, veremos os tipos existentes.
Quais os tipos de pilhas?
- Pilhas alcalinas: têm em sua composição dióxido de manganês (MnO2) + zinco (Zn) + eletrólito alcalino de KOH (por isso o nome). Para saber mais, clique aqui.
- Pilhas de zinco-carbono (Leclanché): são formadas por cloreto de zinco (ZnCl2) ou amônio (NH4Cl), um ácido, como eletrólito. São mais baratas, porém menos duráveis que as alcalinas, sendo usadas em dispositivos de baixo consumo, como relógios de parede. Saiba mais sobre essas pilhas clicando aqui.
- Pilhas de lítio (não recarregáveis): são compostas por lítio metálico (Li) + dióxido de manganês (MnO2) ou outros compostos. São leves, com alta densidade energética e vida útil muito longa. São usadas em câmeras digitais e em dispositivos médicos, como marcapassos.
- Pilhas de óxido de prata: são compostas por óxido de prata (Ag2O) + zinco (Zn). São estáveis e precisas, mas caras. São usadas em relógios de pulso, calculadoras.
- Pilhas de zinco-ar: funcionam com zinco + oxigênio do ar. São aplicadas em aparelhos auditivos por terem alta capacidade para tamanho reduzido.
Componentes das pilhas
As pilhas são compostas por três elementos principais: ânodo, cátodo e eletrólito.
- O ânodo é o eletrodo em que ocorre a oxidação (polo negativo), liberando elétrons para o circuito externo.
- O cátodo (polo positivo) é o eletrodo em que acontece a redução, recebendo esses elétrons.
- O eletrólito é a substância que permite a movimentação de íons, garantindo o equilíbrio de cargas e a continuidade da reação química.
Além desses componentes, algumas pilhas têm uma ponte salina ou um separador, que evita o contato direto entre os eletrodos, prevenindo curtos-circuitos. Já a carcaça da pilha protege os materiais internos e pode atuar como um dos eletrodos, dependendo do modelo.
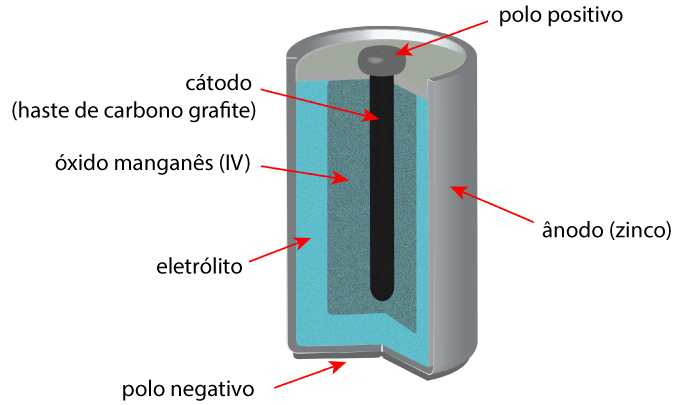
É importante ressaltar que as pilhas alcalinas usadas atualmente em dispositivos do dia a dia seguem o modelo da pilha de Leclanché, também conhecida como pilha seca comum. Foi desenvolvida, em 1868, por George Leclanché. Diferentemente das pilhas primitivas, que utilizavam soluções líquidas como eletrólito, essa pilha emprega uma pasta eletrolítica, o que reduz o risco de vazamentos e aumenta sua praticidade. A diferença é que enquanto na de Leclanché é o eletrólito usado é NH4, na alcalina usa-se KOH.
Diferença entre pilhas e baterias
A diferença entre pilhas e baterias está na forma como armazenam e fornecem energia. Enquanto as pilhas são formadas por unidades individuais, além de terem uma tensão fixa e serem utilizadas em dispositivos de menor consumo, como controles remotos e relógios, as baterias, por sua vez, são compostas por duas ou mais pilhas conectadas em série ou paralelo, permitindo maior voltagem ou capacidade de carga. Isso as torna adequadas para dispositivos que exigem mais energia, como celulares, notebooks e veículos elétricos.
Apesar dessa diferença, comercialmente, é comum encontrarmos baterias do tipo níquel-metal-hidreto (NiMH) sendo vendidas como pilhas devido ao seu formato, conforme é mostrado a seguir.

Além disso, existem diferentes composições e aplicações dentro dessas categorias, como a bateria de níquel-cádmio (NiCd) e a de chumbo-ácido, cada uma com características específicas.
Diferenças entre pilha AA e AAA
A principal diferença entre pilhas AA e AAA está no tamanho e na capacidade de carga. Assim, as pilhas AA são maiores e têm maior capacidade de armazenamento de energia, sendo utilizadas em dispositivos que demandam mais corrente, como brinquedos, lanternas e controles de videogame. Já as AAA, por outro lado, são menores e armazenam menos energia, sendo indicadas para aparelhos de baixo consumo, como controles remotos, relógios e alguns sensores eletrônicos.

Ambas podem ser alcalinas ou recarregáveis, mantendo a voltagem (geralmente 1,5 V para alcalinas e 1,2 V para recarregáveis), mas com diferenças na duração devido ao tamanho.
Pilha de Daniell
A pilha de Daniell é composta por dois eletrodos: um ânodo de zinco (Zn), no qual ocorre a oxidação, e um cátodo de cobre (Cu), no qual ocorre a redução. Essas semirreações acontecem em soluções eletrolíticas separadas, conectadas por uma ponte salina, que permite a passagem de íons para manter o equilíbrio de cargas, conforme é ilustrado na figura:
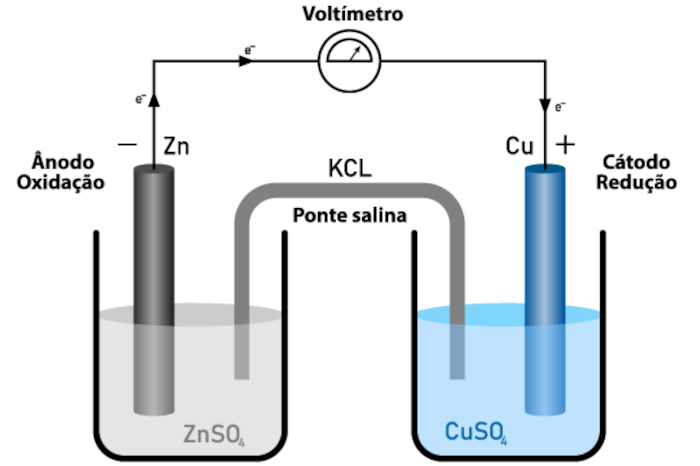
Os princípios da pilha de Daniell ainda são muito utilizados em dispositivos eletroquímicos modernos, incluindo baterias e células galvânicas, de modo que a separação dos eletrodos e o fluxo controlado de elétrons são conceitos aplicados no desenvolvimento de fontes de energia mais eficientes.
Saiba mais: Como evitar acidentes ao carregar a bateria do celular?
Exercícios resolvidos sobre pilhas
1) (Uece-CEV) - O uso de pilhas e baterias é intenso em nossa sociedade. Muitas vezes nem nos damos conta de como essa tecnologia está presente em nosso cotidiano. Um dos tipos de pilha alcalina muito utilizada em aparelhos MP3 contém íons Hg2+. Com relação a esse tipo de pilha, assinale a afirmação correta.
a) Os íons Hg2+ são oxidados a mercúrio metálico quando a pilha está sendo descarregada.
b) A redução dos íons Hg2+ ocorre no cátodo.
c) Quando a pilha está sendo descarregada, os íons Hg2+ são oxidados para íons Hg4+.
d) A redução dos íons Hg2+ ocorre no ânodo.
Gabarito: b
Primeiro devemos lembrar que, na pilha, a oxidação (aumento do NOX) ocorre no ânodo e a redução (diminuição do NOX) no cátodo. Em vista disso, vamos analisar as alternativas:
- ERRADA - De Hg2+ para Hg(s) ocorre uma redução, porquanto o NOX variou duas unidades (de 2 para 0).
- CORRETA.
- ERRADA - Mesma justificativa anterior.
- ERRADA - A redução ocorre no cátodo.
2) (PUC-MINAS) - A pilha Daniell é constituída de um compartimento anódico contendo uma placa de zinco imersa numa solução de sulfato de zinco e de um compartimento catódico contendo uma placa de cobre mergulhada em uma solução de sulfato de cobre. Os dois compartimentos são unidos por uma ponte salina para equilibrar as cargas. É INCORRETO afirmar que durante o funcionamento da pilha Daniel: Afinidade eletrônica.
- Os íons cobres são reduzidos.
- A placa de zinco é consumida.
- Os íons sulfatos são oxidados.
- O polo positivo da pilha é a placa de cobre.
Gabarito: c
Agora, analisando cada alternativa:
- CORRETA - Os íons Cu2+ são reduzidos no cátodo, formando cobre metálico.
- CORRETA - A placa de zinco é consumida porque o metal se oxida, liberando Zn2+ na solução.
- ERRADA - Os íons sulfato (SO42-) não sofrem oxidação, eles apenas equilibram a carga na solução, sem participar diretamente da reação.
- CORRETA - O cátodo (placa de cobre) é o polo positivo, pois recebe elétrons.
Créditos das imagens
[2] © Raimond Spekking / CC BY-SA 4.0 / Wikimedia Commons
[3] Vovantarakan/ Shutterstock
[4] WikimediaCommons
Fontes
BOCCHI, N.; FERRACIN, L. C.; BIAGGIO, S. R. Pilhas e Baterias: Funcionamento e Impacto Ambiental. Quim. Nova Esc., v. 11, p. 3–9, 2000.
FELTRE, R. Eletoquímica: Pilhas e baterias. In: Química: Volume 2 - Físico-Química. 7. ed. São Paulo: Editora Moderna LTDA, 2008. v. 2p. 300–357.
L. BROWN, T. et al. Baterias e células. In: Química: A Ciência Central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 143–144.
PERUZZO, F. M.; CANTO, E. L. DO. Eletroquímica: Celas galvânicas. In: Química na abordagem do cotidiano, Volume 2, Fisico-Química. 3. ed. São Paulo: Editora Moderna, 2003. p. 87–117.
REIS, M. Pilhas e Baterias. In: Química. 1. ed. São Paulo: Editora Ática, 2013. v. 2p. 264–289.


