Diferença entre número de massa e massa atômica
Número de Massa, na verdade, não representa a massa do átomo, mas sim o número ou a quantidade de partículas com massas significativas do átomo. Visto que o elétron tem massa 1836 vezes menor que do próton e do nêutron, sua massa é considerada insignificante para o cálculo da massa total do átomo. Assim, o Número de Massa, cujo símbolo é A, é a soma dos prótons e dos nêutrons existentes no núcleo do átomo:
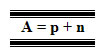
Assim no isótopo do cloro (1735Cl), por exemplo, o número de massa é 35, que é a soma dos 17 prótons com os 18 nêutrons existentes no seu núcleo.
Já a Massa Atômica representa algo muito diferente. Ela não é simplesmente a soma das massas dos prótons e dos nêutrons. Ao se manterem unidos, ocorre perda de massa que é transformada em energia; assim, a massa do átomo é sempre menor que a soma das massas isoladas das partículas nucleares.
Além disso, as massas atômicas dos elementos químicos que aparecem na Tabela Periódica não podem representar a massa só de um isótopo daquele elemento encontrado na natureza, pois de um isótopo para o outro há diferença de números de massas. A quantidade de nêutrons é diferente de um para o outro.
Então, como é calculada a Massa Atômica de um átomo e de um elemento químico?
A Massa Atômica de um elemento químico é a média ponderada das massas atômicas dos isótopos naturais do elemento, multiplicada pela abundância, ou seja, porcentagem em massa de cada isótopo.
Se for a massa atômica de um átomo apenas, é então a massa deste átomo expressa em “u”, ou seja, é medida em unidade de massa atômica (u). A unidade de massa atômica, por sua vez, é igual a 1/12 da massa de um átomo de isótopo do carbono-12 (C12). Sendo que 1 u = 1,66054 . 10-24 g.
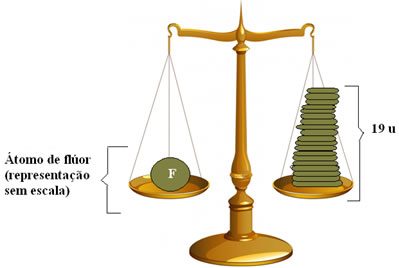
Desse modo, se você ver na Tabela Periódica que a Massa atômica do átomo de Flúor é de 19,00 u, isto significa que o flúor é 19 vezes mais pesado que o 1/12 do isótopo do carbono-12.
Vamos tomar outro exemplo e mostrar como isto é feito para um elemento químico. Na natureza, as abundâncias relativas dos isótopos do neônio são dadas por:
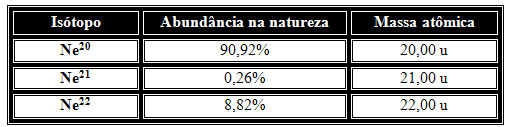
Fazendo a média ponderada temos:
20,00 . 90,92 + 21,00 . 0,26 + 22,00 . 8,82 = 20,179 u
100
Portanto, o valor da massa atômica do elemento neônio na Tabela Periódica é dada por 20,179 u, ou por seu valor aproximado 20,18u.
Por Jennifer Fogaça.
Graduada em Química.

