Massa Atômica de um Átomo
“A massa atômica de um átomo é a sua massa determinada em unidades de massa atômica (u), sendo que 1 u é igual a 1/12 da massa de 1 átomo de carbono 12.”
Essa definição pode parecer um tanto complicada quando se lê inicialmente, mas ao longo deste texto você verá que é bem simples.
Para começar, pense em quando você vai a um supermercado comprar arroz. Geralmente, você compra sacos de 2 kg ou de 5 kg, não é mesmo?! Esse exemplo serve para mostrar que a massa de um corpo é determinada através da comparação com uma unidade-padrão conveniente. No caso do saco de arroz, a unidade escolhida para servir de padrão de comparação foi o quilograma (kg).
O quilograma-padrão equivale a um cilindro de 3,917 cm de altura e de diâmetro, feito de 10% de irídio e 90% de platina. Ele fica guardado no interior de três cúpulas de vidro na sede do Bureau Internacional de Pesos e Medidas, na cidade de Sèvre, França.
Assim, quando se diz que um saco de arroz tem 5 kg, isso quer dizer que a sua massa é cinco vezes maior que a massa de 1 quilograma. No entanto, se fosse para falar da massa de uma formiga, você não usaria o kg, pois a massa de uma formiga é muito menor que a massa do quilograma-padrão. Isso significa que é importante escolher padrões convenientes para determinar cada medida específica.

Ilustração de relação entre a massa de um pacote de arroz e o quilograma-padrão
Isso se aplica à massa atômica ou massa dos átomos. É impossível pesar um átomo em uma balança e dizer a sua massa, pois os átomos são tão pequenos que nem mesmo os microscópios mais modernos conseguem enxergá-los.
Por isso, os cientistas decidiram escolher como padrão de medida da massa atômica a massa de um átomo específico. Atualmente, o carbono 12 é o átomo que serve como referência para a determinação da massa dos outros átomos.
A massa atômica do carbono 12 é exatamente 12 u. Assim, 1 u (uma unidade de massa atômica) é igual a 1/12 da massa do carbono 12.
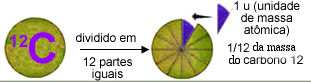
A unidade de massa atômica é 1/12 da massa do carbono 12
Por isso, podemos dizer que a massa atômica, expressa em u, indica quanto a massa de 1 átomo de certo elemento químico é maior que a massa de 1 u. Sabe-se que 1 u é igual a 1,66054 . 10-24 g.
Por exemplo, o hidrogênio possui três isótopos diferentes na natureza, e o mais comum deles é o 1H. A massa atômica do 1H é igual a 1 u (valor arredondado), o que quer dizer que a massa de 1 átomo de hidrogênio é exatamente igual a 1/12 da massa do carbono 12.
Por outro lado, a massa do isótopo mais comum do hélio é 4 u, o que quer dizer que a massa do átomo de hélio é quatro vezes maior que a massa de 1/12 do carbono 12.
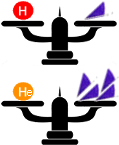
Massas atômicas do hidrogênio e do hélio em comparação com 1 unidade de massa atômica (1/12 da massa do carbono 12)
Hoje as massas atômicas dos átomos são normalmente medidas por meio de um aparelho chamado de espectrômetro de massa.
No Ensino Médio, costumamos usar os valores das massas atômicas de forma arredondada. Por exemplo, a massa atômica do isótopo principal do hélio é, na realidade, 4,00030 u, mas usamos somente 4 u. Ao fazer isso, vemos que o valor da massa atômica fica exatamente igual ao número de massa (A) do átomo, que é a soma dos prótons e dos nêutrons que existem no núcleo atômico. Veja como isso ocorre no caso do hélio: ele possui dois prótons e dois nêutrons no núcleo, portanto, seu número de massa é igual a 4.
Na Tabela Periódica, costumam aparecer abaixo do símbolo de cada elemento as respectivas massas atômicas. Porém, esses valores não são a massa atômica de um átomo, mas sim a massa atômica de um elemento. Veja a diferença lendo o texto abaixo:

