Variação da pressão atmosférica e ponto de ebulição

O valor da temperatura de ebulição da água, de outros líquidos e de soluções é influenciado pela pressão atmosférica.

É bem sabido que o ponto de ebulição da água ao nível do mar (pressão atmosférica igual a 1 atm ou 760 mmHg e altitude igual a zero) é igual a 100ºC. No entanto, se fervermos a água em Brasília, o valor da temperatura de ebulição será um pouco menor, aproximadamente igual a 98,3ºC. Isso ocorre porque Brasília possui uma altitude acima do nível do mar, possuindo uma pressão atmosférica menor e, com isso, o ponto de ebulição da água também será menor.

O Rio de Janeiro fica ao nível do mar e Brasília fica acima do nível do mar, por isso a água ferve mais rápido nessa última cidade*
Quanto maior a altitude, menor será o ponto de ebulição. Por exemplo, o Monte Everest fica na Cordilheira do Himalaia, cuja altitude é de 8848m e sua pressão atmosférica é de 240 mmHg. Nesse local, a água entra em ebulição muito mais rápido do que ao nível do mar, possuindo um ponto de ebulição de aproximadamente 71°C.

O contrário também ocorre, em lugares que ficam abaixo do nível do mar, a água ferverá a uma temperatura maior do que 100ºC, porque a pressão será maior, como mostra o gráfico abaixo:
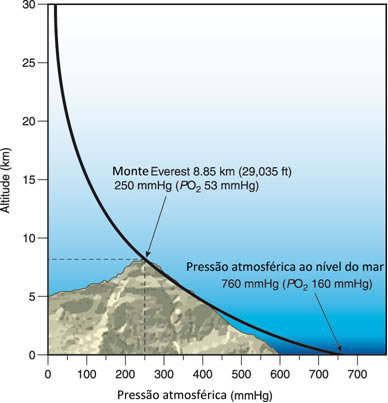
Mas por que a pressão atmosférica exerce essa influência no ponto de ebulição?
Para entender isso, vejamos o que é a ebulição. Quando colocamos a água para aquecer, a energia recebida pelas moléculas possibilita que elas passem para o estado de vapor. Inicialmente podemos ver no fundo do recipiente a formação de bolhas de vapor de água, e só depois de receber mais energia na forma de calor é que essas bolhas sobem e são liberadas na superfície, entrando em ebulição.
As bolhas ficam no fundo do recipiente porque a pressão atmosférica exerce uma força sobre a superfície do líquido, como que empurrando a bolha de vapor para baixo. A pressão dentro da bolha vai aumentando cada vez mais, até que ela se iguala à pressão atmosférica e, dessa forma, sobe, entrando em ebulição. A temperatura no momento em que isso ocorre é o ponto de ebulição.
Assim, quanto maior for a pressão sobre a superfície, mais difícil será para suplantá-la e para o líquido entrar em ebulição, logo, o ponto de ebulição será maior. Por outro lado, se a pressão for menor, será mais fácil entrar em ebulição e o ponto de ebulição será menor.
Isso nos ajuda a entender o princípio de funcionamento da panela de pressão. Dentro dela a pressão sobre a água é bastante elevada, o que faz com que a água permaneça no estado líquido em temperaturas maiores que 100 ºC. Temperaturas mais elevadas aceleram as mudanças físicas e químicas que ocorrem durante o cozimento de alimentos.

No entanto, se quisermos cozinhar algum alimento em lugares de altitude muito elevada, como o Monte Everest, em panelas comuns, será muito difícil. Isso porque a água irá entrar em ebulição e secar antes mesmo que o alimento termine de cozinhar.
* Créditos da imagem de Brasília: gary yim e Shutterstock.com
Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias


















