Energia de Ativação e Complexo Ativado
Para que uma reação ocorra, é necessário que os reagentes recebam certa quantidade de energia, que é denominada de energia de ativação. Assim, temos:

Por exemplo, na atmosfera existem os gases oxigênio (O2) e nitrogênio (N2). Há um grande número de choques entre suas moléculas, porém, a reação só ocorre quando recebe alguma forma de energia externa, que, no caso, costuma ser fornecida pelas descargas elétricas dos relâmpagos.
Assim, quanto maior a energia de ativação, mais difícil será para que a reação ocorra e, consequentemente, ela se dará de forma mais lenta. O contrário também é verdadeiro, reações com uma menor energia de ativação ocorrem com maior velocidade. Isso significa que a energia de ativação é na verdade uma barreira energética a ser ultrapassada para que ocorra a reação química.
Quando a energia de ativação é atingida, forma-se primeiro o complexo ativado, que é uma estrutura intermediária e instável entre os reagentes e os produtos.

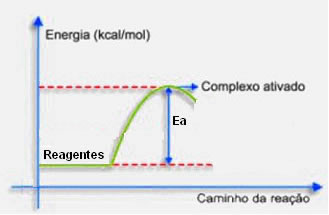
Abaixo temos uma reação genérica que demonstra a formação do complexo ativado:
.jpg)
Portanto, a energia de ativação é a menor energia necessária que se deve fornecer aos reagentes para a formação do complexo ativado, resultando na ocorrência da reação.
Isso pode ser representado graficamente, conforme mostrado a seguir:
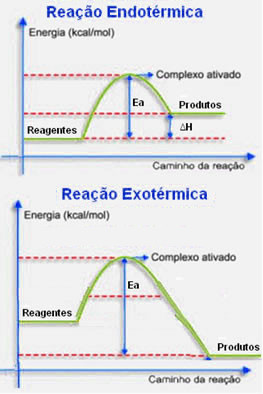
Observe abaixo como escrever os digramas tanto para reações endotérmicas como exotérmicas:
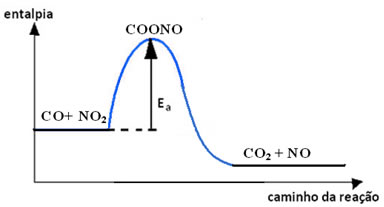
Um exemplo que pode ser citado é a reação que ocorre entre o monóxido de carbono (CO) e o dióxido de nitrogênio (NO2) para a formação do gás carbônico (dióxido de carbono - CO2) e o óxido de nitrogênio (NO):
CO(g) + NO2(g) → CO2(g) + NO(g)
Com o estado intermediário (complexo ativado), temos:
CO+ NO2 → COONO → CO2 + NO
A representação gráfica dessa reação, com o seu complexo ativado e sua energia de ativação, é descrita abaixo: