Energia de Ligação

Observe a reação de formação de átomos de hidrogênio isolados, a partir de 1 mol de moléculas do gás hidrogênio abaixo:
H2(g) → 2 H(g) ?H = +435 kJ
Note que é preciso o fornecimento de 435 kJ de energia ao sistema. A energia é necessária na primeira etapa da reação, em que ocorre a quebra da ligação covalente do gás hidrogênio. Visto que absorve energia, esse é um processo endotérmico.
O mesmo ocorre em outros tipos de reação, inclusive com duplas e triplas ligações. Nesses casos, a energia de ligação corresponderá à energia necessária para romper 1 mol de ligações duplas e triplas, respectivamente. Como nos casos a seguir:
O2(g) → 2 O(g) ?H = +497,8 kJ
O?O(g) → 2 O(g) ?H = +497,8 kJ
N2(g) → 2 N(g) ?H = +943,8 kJ
N≡N(g) → 2 N(g) ?H = +943,8 kJ
Assim, esse valor da energia de ligação será o valor da variação de entalpia (?H) da reação.
No entanto, quando as reações em questão envolverem não só a quebra das ligações, mas também a formação de novas ligações, será necessário somar todas as energias envolvidas em todas as ligações, para determinar a entalpia da reação.
É importante lembrar que à medida que ocorre a formação da nova ligação, a energia é liberada, sendo, portanto, um processo exotérmico.
Para entendermos como se determina a energia total absorvida, veja o exemplo abaixo, da reação de formação do HCl(g):
H2(g) + Cl2(g) → 2 HCl(g) ?H = ?
H?H(g) + Cl?Cl(g) → 2 H?Cl(g) ?H = ?
Nesse caso, para romper 1 mol de ligação H?H, a absorção de 436 kJ é necessária. E para romper 1 mol de Cl?Cl, absorve-se 242,6 kJ. Somando esses dois valores, obtemos a quantidade de energia absorvida: ?H = +678,6 kJ. Lembrando que o resultado é positivo, pois a energia foi absorvida; e, em processos endotérmicos, o valor da entalpia é sempre positivo.
Já na formação de 1 mol de ligação H?Cl, foram liberados 431,8 kJ. O total de energia liberada é de 836,6 kJ, visto que na reação são formados 2 mols. Sendo um processo exotérmico, esse valor é dado como negativo.
Descobrimos o valor de ?H somando esses valores:
?H =?Henergia total absorvida + ?Henergia total liberada
?H = (431,8 + (-836,6) kJ)
?H = - 182 kJ
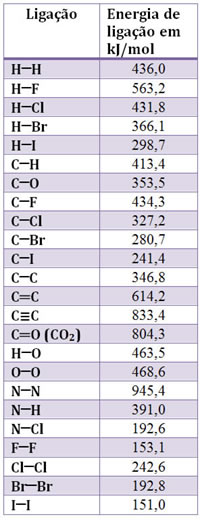
Usando esse método é possível determinar a entalpia de muitas reações. Na tabela abaixo constam os valores medidos de algumas energias de ligação: