Força ácida
O meio ácido é caracterizado pela presença de íons H+ gerados pela ionização (formação de íons). A facilidade com que os ácidos se ionizam em água e outros solventes é determinada pela força ácida. Os ácidos considerados fortes liberam H+ com maior facilidade.
Para saber se um ácido é forte, fraco ou moderado, precisamos analisar a relação entre o número de moléculas ionizadas e o número total de moléculas dissolvidas.
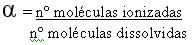
Onde α (alfa) representa o grau de ionização do ácido.
Exemplo: o ácido bromídrico (HBr) sofre ionização quando dissolvido em água, liberando íons H+ e Br-, veja a equação:
HBr → H+ + Br-
Qual a quantidade de moléculas de HBr sofre ionização? Se for avaliadas 100 moléculas de HBr em meio aquoso, e constatarmos que mais de 50% delas sofreu ionização, como podemos classificar esse ácido?
A tabela abaixo classifica um ácido como forte, moderado ou fraco baseando-se no grau de ionização:

• Ácido forte: aquele que tem quantidade igual ou acima de 50% de suas moléculas ionizadas em meio aquoso.
• Ácido moderado (ou semiforte): a ionização ocorre entre 5% a 50% das moléculas do ácido.
• Ácido fraco: a ionização não ultrapassa a porcentagem de 5% de moléculas.
De acordo com a tabela, podemos classificar o HBr como ácido forte.
Exemplo de ácido fraco
O ácido carbônico (H2CO3) se ioniza segundo a equação:
H2CO3 ↔ H2O +CO2
Os produtos da reação são gás carbônico (CO2) e água (H2O). O H2CO3 é classificado como ácido fraco porque apresenta um pequeno grau de ionização (α ≤ 5%).
Mais exemplos:
Ácidos fortes: ácido clorídrico (HCl), ácido iodídrico (HI), ácido sulfúrico (H2SO4).
Ácidos moderados: ácido fluorídrico (HF), ácido fosfórico (H3PO4).
Ácidos fracos: ácido acético (CH3COOH), ácido cianídrico (HCN).
Veja mais!
Propriedades e classificação dos ácidos
