Lei de Graham
O químico escocês Thomas Graham nasceu em 1805 em Glasgow e formou-se na Universidade dessa mesma cidade, no ano de 1826. Sua pós-graduação foi em Edimburgo, voltando em 1828 para a sua cidade natal.
Esse cientista passou grande parte de seu tempo estudando a difusão dos gases e líquidos.
No caso dos gases, ele observou que, quando um gás se difunde por outro meio gasoso, a sua densidade interfere na velocidade dessa difusão. Com isso, em 1828, ele enunciou a seguinte lei:
Lei de Graham: A velocidade de difusão e de efusão de um gás é inversamente proporcional à raiz quadrada de sua densidade.
Matematicamente, podemos expressar isso da seguinte forma:
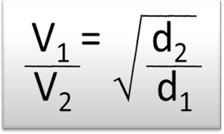
Isso quer dizer que quanto menos denso for o gás, maior será sua velocidade de difusão e efusão. É claro que essa relação se dá a partir da constatação de que ambos os gases estão em uma mesma temperatura e pressão, o que nos leva à outra conclusão: nessas condições, as relações entre as densidades de dois gases são iguais à relação entre as suas massas molares.
Observe abaixo essa relação matemática:
·Se a temperatura dos gases é a mesma, então a energia cinética deles também é igual:
Gás 1 Gás 2
T1 = T2
E1 = E2
·A energia cinética é dada pela fórmula: m . v2/2. Então, temos:
Gás 1 Gás 2
m1. v12 = m2. V22
2 2
m1. v12 = m2. v22
v12 = m2
v22 m1
-
Considerando que “m” é a massa molecular ou molar (M) de cada gás, teremos:
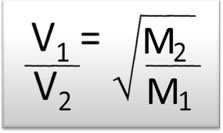
Isso nos mostra que a massa molar do gás também interfere na sua velocidade, pois quanto menor for essa massa, mais fácil será para o gás realizar a difusão ou a efusão.
Por exemplo, se dois frascos forem abertos ao mesmo tempo, sendo que um contém vinagre (ácido acético (C2H4O2)) e o outro contém detergente amoniacal (libera amônia gasosa (NH3)), o cheiro que vamos sentir primeiro será o da amônia, porque a sua massa molar é menor que a do ácido acético.
Veja como a Lei de Graham é aplicada na resolução de problemas envolvendo o fenômeno de difusão e efusão dos gases:
Exemplo: (Mackenzie-SP) A velocidade de difusão do gás hidrogênio é igual a 27 km/min, em determinadas condições de pressão e temperatura (massas atômicas: H = 1; O = 16). Nas mesmas condições, a velocidade de difusão do gás oxigênio em km/h é de:
a)4 km/h
b)108 km/h
c)405 km/h
d)240 km/h
e)960 km/h
Resolução:
Usando a fórmula que relaciona a velocidade de difusão dos gases com as suas respectivas massas molares, temos:
vH2 2 = MO2
vO2 2 MH2
27 km/min2 = 32 g/mol
vO22 2 g/mol
27 km/min = √ 16
vO2
27 km/min = 4
vO2
4 vO2 = 27 km/min
vO2 = 27 km/min
4
vO2 = 6,75 km/min
Passando para km/h, temos:
vO2 = 6,75 . 60 = 405 km/H
Alternativa “c”.
* Créditos editoriais da imagem: Georgios Kollidas / shutterstock.com

