Influência da Concentração no Deslocamento do Equilíbrio Químico

Conforme dito no texto “O Princípio de Le Chatelier”, se um equilíbrio químico sofrer alguma perturbação, ele tende a se reajustar no sentido de diminuir os efeitos dessa força. Portanto, se alterarmos algo na reação ocorrerá um deslocamento do equilíbrio.
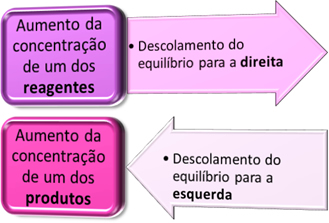
Um dos fatores que podem influenciar no deslocamento do equilíbrio químico é a concentração, tanto dos reagentes como dos produtos.
Resumidamente, temos que:
Considere a seguinte reação genérica, em que as letras minúsculas são os coeficientes da equação e as letras maiúsculas são as substâncias:
a X + b Y ↔ c Z
- Se aumentarmos a concentração de X ou de Y: deslocaremos o equilíbrio para a direita (→);
- Se aumentarmos a concentração de Z: deslocaremos o equilíbrio para a esquerda (←);
- Se diminuirmos a concentração de X ou de Y: deslocaremos o equilíbrio para a esquerda (←);
- Se diminuirmos a concentração de Z: deslocaremos o equilíbrio para a direita (→).
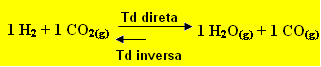
Mas, por que isso ocorre? Vejamos uma reação simples em equilíbrio e vejamos o que ocorre em três possíveis situações:
1 H2 + 1 CO2(g) ↔ 1 H2O(g) + 1 CO(g)
Tddireta = Tdinversa
1ª situação: Adição de H2 e CO2
Se adicionarmos CO2(g) e H2(g) no equilíbrio, imediatamente as suas concentrações irão aumentar, aumentando também o número de choques efetivos que ocorrem entre suas moléculas. Desse modo, haverá um aumento na taxa de desenvolvimento da reação direta, para diminuir a quantidade de CO2(g) e H2(g) adicionados e levando à formação de mais H2O(g) e CO(g). Isso significa que o equilíbrio estará sendo deslocado para a direita.
Com o tempo, a concentração de CO2(g) e de H2(g) diminuirá e a concentração de H2O(g) e CO(g) aumentará, até que o sistema entre novamente em equilíbrio.
Esse deslocamento também pode ser entendido por meio da constante do equilíbrio (Kc), que é dada por:
Kc = [H2O] . [CO]
[H2] . [CO2]
Ao adicionarmos CO2(g) e H2(g) no equilíbrio, estamos aumentando a sua concentração ([H2] .[CO2] ↑). Kc é constante, não varia, portanto, a concentração de H2O(g) e CO(g) ([H2O] . [CO] ↑) também terá de aumentar para manter a quantidade matemática.
2ª situação: Adição de H2O(g) e CO(g)
Nesse caso, ocorre o efeito contrário do visto anteriormente, porque será aumentada a concentração dos produtos, que serão transformados parcialmente em H2O(g) e em CO(g). O equilíbrio será forçado a se deslocar para a esquerda.

3ª situação: Remoção de H2O(g) e CO(g)
Se retirarmos parte de H2O(g) e de CO(g) suas concentrações irão diminuir e, consequentemente, a taxa de desenvolvimento da reação inversa irá ficar menor e o equilíbrio será deslocado para a direita.

ATENÇÃO: É importante ressaltar que isso não vale para compostos sólidos, porque a concentração de um sólido é constante e não depende da quantidade. Portanto, se alterarmos a quantidade de um reagente e/ou produto sólido, o equilíbrio não será deslocado.
Ferramentas Brasil Escola


Últimas notícias
Outras matérias




















