Influência da Temperatura no Deslocamento do Equilíbrio Químico

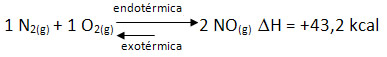
Para entendermos como a variação na temperatura do sistema afeta o equilíbrio químico, consideremos a seguinte reação entre os gases nitrogênio e oxigênio para a formação do monóxido de nitrogênio.
.jpg)
Observe que a reação direta é endotérmica, ou seja, ocorre com absorção de calor. Já a reação inversa é exotérmica, liberando calor.
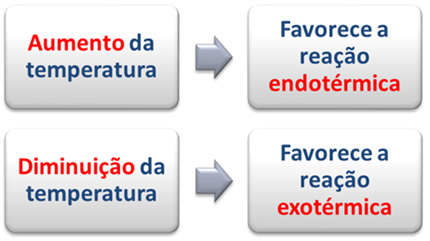
Portanto, se aumentarmos a temperatura desse sistema, o equilíbrio se deslocará no sentido da reação endotérmica, para a direita (→), no sentido de formação do produto.
Isso ocorre porque segundo o princípio de Le Chatelier, se um sistema em equilíbrio sofrer alguma perturbação - como a variação da temperatura, por exemplo – ele tende a se deslocar no sentido de minimizar essa perturbação.
Assim, a reação endotérmica absorve o calor, minimizando os efeitos do aumento o equilíbrio.
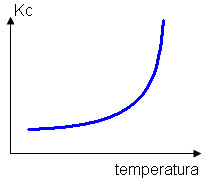
O aumento da temperatura também afeta a constante de equilíbrio do sistema (Kc), porque mais NO será formado, aumentando a sua concentração e, consequentemente, o valor de Kc também aumentará:
Kc = _[NO]_↑ Kc aumenta
[N2] . [O2] ↓
No entanto, se diminuirmos a temperatura, isso favorecerá a reação exotérmica, que libera calor. No exemplo que estamos considerando, a diminuição da temperatura deslocará o equilíbrio para a esquerda.
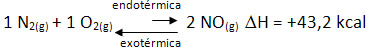
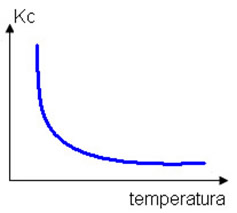
Já a constante de equilíbrio sofrerá uma diminuição:
Kc = _[NO]_ ↓ Kc diminui
[N2] . [O2] ↑
Resumidamente, temos:
Ferramentas Brasil Escola

Artigos Relacionados

Últimas notícias
Outras matérias



















