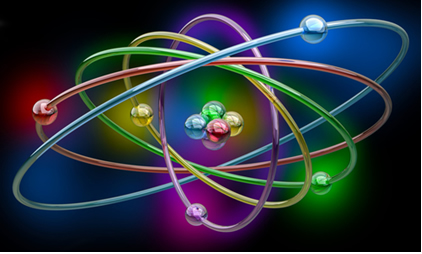
Isótopos, Isótonos, Isóbaros e Isoeletrônicos
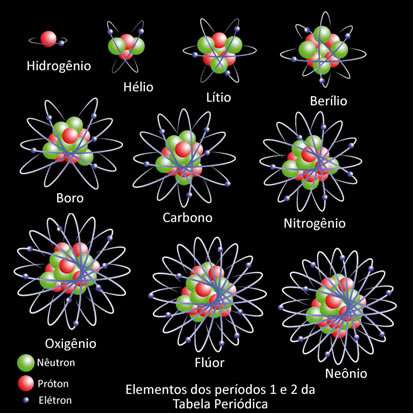
Um elemento químico é conceituado como um conjunto de átomos que possuem o mesmo número atômico (Z), isto é, a mesma quantidade de prótons no núcleo. Na figura a seguir, temos diferentes átomos, todos com a mesma estrutura (um núcleo com nêutrons e prótons e uma eletrosfera com elétrons). Mas, cada tipo de átomo possui uma quantidade de prótons diferentes e com isso o elemento muda.
Por exemplo, o átomo do hidrogênio possui número atômico igual a 1, pois ele tem apenas um próton em seu núcleo. Já o hélio possui dois elétrons e, assim, sucessivamente.
Um elemento químico é representado colocando-se o seu símbolo no meio, o número atômico na parte inferior e o número de massa (A) na parte superior, como mostrado a seguir:
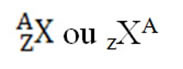
O número de massa, A, é a soma das partículas que estão no núcleo, ou seja, dos prótons e dos nêutrons:A = N + P.
As informações consideradas até aqui são importantes para se entender determinadas semelhanças que existem entre átomos de um mesmo elemento e entre átomos e íons de elementos diferentes. As semelhanças atômicas que serão explicadas a seguir são: isótopos, isótonos, isóbaros e isoeletrônicos. Veja cada caso:

Essa é a semelhança atômica mais importante, pois praticamente todos os elementos químicos possuem isótopos naturais ou artificiais. Visto que possuem o mesmo número atômico, isso significa que átomos isótopos pertencem a um mesmo elemento químico. Por exemplo, o hidrogênio, conforme já mencionado, possui 1 próton apenas. Mas, na natureza, são encontrados três isótopos do hidrogênio, que são:
11H 12H 13H
prótio ou deutério ou trítio ou
hidrogênio comum hidrogênio pesado hidrogênio superpesado
Observe que a diferença está no número de massa, o que significa que eles possuem número de nêutrons diferentes. O hidrogênio comum possui 0 nêutrons, o deutério possui 1 nêutron e o trítio possui 2 nêutrons.

Nesse caso, trata-se de elementos químicos diferentes, pois o número atômico não é igual.
Exemplos: 1737Cl e o 2040Ca.
Para descobrirmos o número de nêutrons desses elementos e sabermos se eles são mesmo isótonos, basta diminuir o número de massa (A - na parte superior) pelo número de prótons (na parte inferior):
1737Cl 2040Ca
A = N + P A = N + P
N = A – P N = A – P
N = 37-17 N = 40 – 20
N = 20 N = 20

Esses átomos também são de elementos químicos diferentes.
Exemplo: 1940K e o 2040Ca (A = 40).

Um exemplo que podemos citar é entre o átomo de neônio (1020Ne) e o cátion de sódio (1123Na+1). Observe que o neônio está no estado fundamental, ou seja, ele é neutro, o que significa que possui a mesma quantidade de prótons e elétrons. Na sua parte inferior é mostrado o número de prótons, portanto, podemos concluir que ele possui 10 elétrons.
No caso do cátion sódio, ele possuía no estado fundamental 11 elétrons, mas a carga +1 indica que ele perdeu 1 elétron, ficando, então, com 10 elétrons.
Assim, tanto o íon sódio quanto o átomo do neônio apresentam dez elétrons.