Equação geral dos gases
Um gás pode passar por três tipos de variáveis de estado: quanto ao seu volume, quanto à temperatura e quanto à pressão. Essas alterações são conhecidas como transformação isobárica, isovolumétrica e isotérmica. A partir dessas três transformações gasosas é que se chegou à equação:
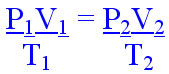
Essa é conhecida como a equação geral dos gases, que aborda as três variáveis de estado (P, V e T).
A equação geral nos permite calcular, por exemplo, o volume de um gás que passou por alterações de temperatura e pressão.
Um objeto prático que nos ajuda a entender a aplicação deste princípio: as latas de aerossóis. Os rótulos aconselham a não deixar esse tipo de recipiente em ambientes quentes ou expostos ao fogo, sabe por quê?
Observando a equação geral dos gases:
.jpg)
Podemos perceber que P, T, V são grandezas proporcionais, ou seja, o aumento de um incute no aumento de outro.
Considerando a presença do gás dentro do recipiente, e que altas temperaturas provocam aumento excessivo da pressão, o que acontece então quando aquecemos uma lata de spray?
Ela explode na presença de altas temperaturas. O aumento da pressão exercida pelo gás, ocasionada pelo aumento da temperatura absoluta, explode a lata.

