Modelo de orbitais e distribuição eletrônica
Os orbitais são regiões na eletrosfera do átomo em que é máxima a probabilidade de se encontrar o elétron, ou a função de onda que descreve o movimento de um elétron.
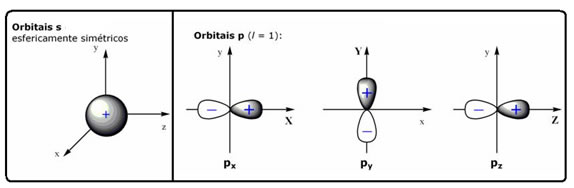
Os orbitais são representados por nuvens eletrônicas e são diferentes para cada tipo de ligação; assim, para uma ligação do tipo s temos um orbital esférico; e para uma ligação p, temos um orbital na forma de duplo ovoide. Para o orbital de tipo p, há três possibilidades, pois existem três orientações espaciais possíveis (x, y, z):
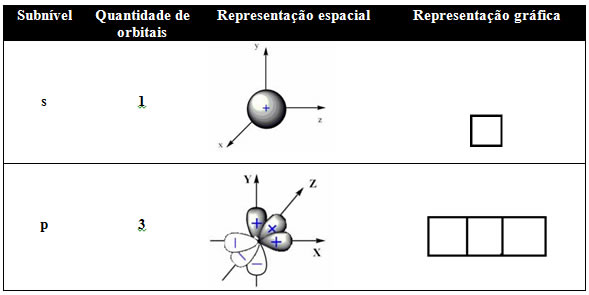
Esses orbitais são representados graficamente por ○ ou □:
Segundo o Princípio de Exclusão de Pauli, em cada orbital cabem no máximo dois elétrons. Para os orbitais que não possuem os dois elétrons, dizemos que estão incompletos e que são elétrons isolados ou desemparelhados.
Além disso, ao se preencher os orbitais, isto é, fazer a distribuição eletrônica, isso deve ser feito segundo a Regra de Hund ou Regra de máxima multiplicidade, que diz que esse preenchimento deve ser feito de um modo que se obtenha o maior número possível de orbitais desemparelhados. Nesse preenchimento, normalmente se simboliza cada elétron por uma seta (voltada para cima ou para baixo) com o sentido de acordo com o spin do elétron.
Em termos simples, isso significa que ao preenchermos os orbitais, primeiro devemos preencher todos eles com apenas uma seta cada um, sendo que todas estarão voltadas para o mesmo sentido e, se ainda houver mais elétrons, continua-se preenchendo os orbitais com setas no outro sentido.
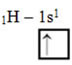
Por exemplo, o hidrogênio (H) é o elemento mais simples, pois possui apenas um elétron, portanto ele só possui um orbital do tipo p com um elétron, que é representado da seguinte forma:
Já o hélio possui dois elétrons; assim, para ele, temos:
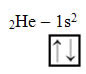
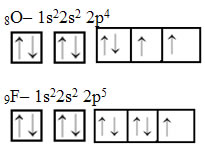
Veja a seguir outros exemplos com mais elétrons:
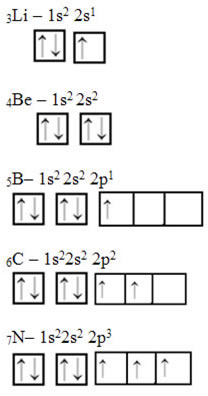
Nesses dois últimos casos é possível ver que a distribuição eletrônica é feita primeiro preenchendo todos os orbitais com apenas um elétron cada um, num mesmo sentido (veja que todas as setas estão para cima). Nos exemplos a seguir, mostra que só depois que todos os orbitais foram preenchidos com um elétron é que se preenche com o outro elétron.