Propriedades gerais da matéria
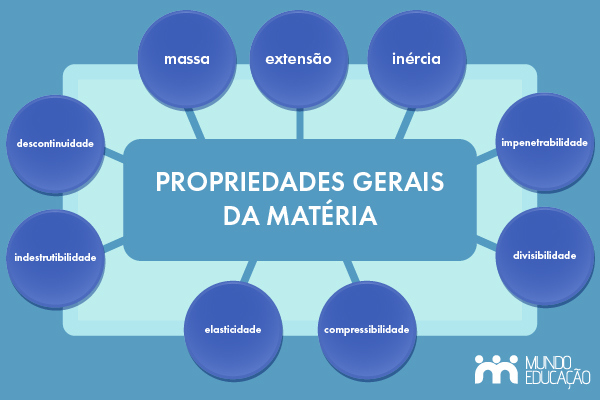
Propriedades gerais da matéria são características universais compartilhadas por todos os tipos de matéria, independentemente de sua composição ou estado físico. As propriedades gerais da matéria são: extensão, inércia, impenetrabilidade, divisibilidade, compressibilidade, elasticidade, indestrutibilidade e descontinuidade.
Não se deve confundir propriedades gerais da matéria com as propriedades específicas. Enquanto as gerais são comuns a qualquer tipo de matéria, as específicas são características que variam conforme o material.
Leia também: Diferenças entre fenômenos físicos e químicos
Resumo sobre as propriedades gerais da matéria
-
As propriedades gerais da matéria são: extensão, inércia, impenetrabilidade, divisibilidade, compressibilidade, elasticidade, indestrutibilidade e descontinuidade.
-
Massa é a quantidade de matéria em um corpo, medida em unidades do Sistema Internacional (SI), como o quilograma (kg) ou o grama (g).
-
Extensão é o espaço ocupado pela matéria.
-
Inércia é a resistência natural que um corpo apresenta a mudanças no seu estado de movimento ou repouso.
-
Impenetrabilidade diz respeito ao fato de que dois corpos não podem ocupar o mesmo espaço ao mesmo tempo.
-
Divisibilidade é a capacidade da matéria de ser dividida em partes menores.
-
Compressibilidade é a capacidade da matéria de ter seu volume reduzido quando submetida a uma força externa.
-
Elasticidade é a capacidade de um material retornar à sua forma original após ser deformado por uma força.
-
Indestrutibilidade é o princípio fundamental de que a matéria não pode ser destruída, apenas transformada.
-
Descontinuidade refere-se ao fato de que a matéria não é contínua, sendo composta por partículas microscópicas e espaços vazios.
-
As propriedades gerais da matéria são comuns a todos os tipos de materiais. Já as propriedades específicas distinguem as substâncias entre si e dependem de sua composição química e estrutura física.
Quais são as propriedades gerais da matéria?
As propriedades gerais da matéria são aquelas que se aplicam a qualquer tipo de matéria, independentemente de sua natureza química ou estado físico. São elas:
→ Massa
É uma propriedade fundamental da matéria que representa a quantidade de matéria em um corpo. Ela é uma grandeza escalar, ou seja, possui apenas magnitude (sem direção), e é medida em unidades do Sistema Internacional (SI), como o quilograma (kg) ou o grama (g).
A massa de um objeto é invariável, ou seja, não muda de acordo com o local onde o objeto se encontra, diferentemente do peso, que depende da gravidade. Isso significa que a massa de um objeto será a mesma tanto na Terra quanto na Lua, mesmo que seu peso seja diferente. Por exemplo, um litro de água pura tem uma massa de exatamente 1 kg, devido à densidade da água ser 1 g/cm3 em condições normais de temperatura e pressão.
→ Extensão
Refere-se ao espaço ocupado pela matéria. Em termos simples, todo corpo material possui extensão porque ocupa uma região no espaço físico. Essa propriedade é uma característica intrínseca de qualquer forma de matéria, independentemente de seu estado de agregação (sólido, líquido ou gasoso).
A extensão está diretamente relacionada ao conceito de volume, que é a medida quantitativa do espaço ocupado por um corpo. O volume é uma grandeza tridimensional, ou seja, considera a largura, altura e profundidade do objeto. Sua unidade no Sistema Internacional (SI) é o metro cúbico (m3), embora outras unidades, como o litro (L) e o centímetro cúbico (cm3), sejam amplamente utilizadas em contextos práticos.
Por exemplo, um cubo sólido de madeira com arestas (a) de 1 metro possui uma extensão porque ocupa espaço no ambiente.
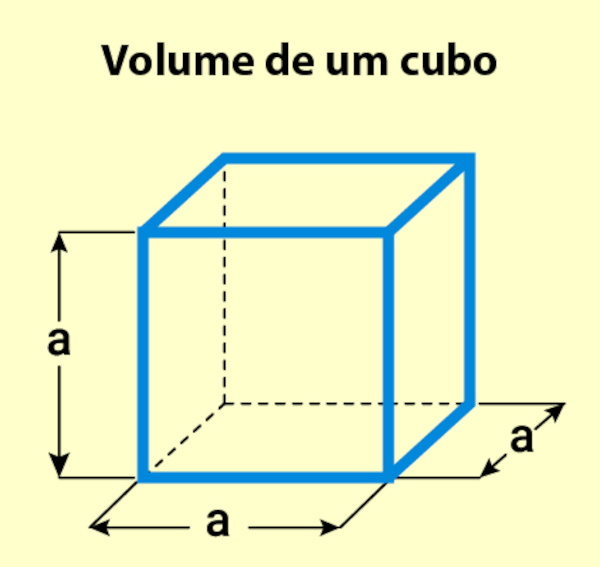
O volume desse cubo pode ser calculado como:
Volume = aresta3 =1 m × 1 m × 1 m = 1 m3
Isso indica que o cubo ocupa exatamente 1 metro cúbico no espaço.
No caso de um líquido, como 1 litro de água, a extensão é percebida pelo espaço preenchido no recipiente, e seu volume é equivalente a 1 decímetro cúbico (1 dm³).
→ Inércia
É a resistência natural que um corpo apresenta a mudanças no seu estado de movimento ou repouso. Essa propriedade pode ser observada em fenômenos cotidianos, como em um ônibus que freia bruscamente, fazendo os passageiros se inclinarem para frente. A imagem a seguir descreve a inércia de uma caixa que está em cima de um carro e que permanece em movimento mesmo após o carro parar bruscamente.

A inércia depende diretamente da massa do corpo: quanto maior a massa, maior será sua resistência à mudança.
→ Impenetrabilidade
Significa que dois corpos não podem ocupar o mesmo espaço ao mesmo tempo. Por exemplo, ao mergulhar um objeto em um copo cheio de água, parte da água transborda porque o objeto desloca o espaço que antes era ocupado pelo líquido (princípio de Arquimedes), como pode ser visto na imagem a seguir.

→ Divisibilidade
É a capacidade da matéria de ser dividida em partes menores. Um exemplo é o pão, que, após ser fatiado, continua proporcionando o mesmo sabor em cada uma de suas fatias.

→ Compressibilidade
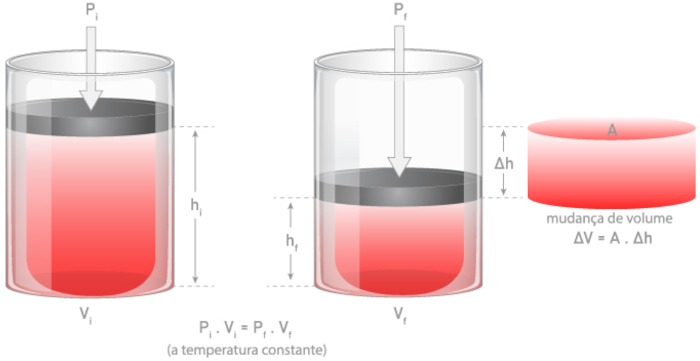
É a capacidade da matéria de ter seu volume reduzido quando submetida a uma força externa. Gases, como o ar, são altamente compressíveis, o que é explorado em sistemas de cilindros de oxigênio comprimido. A imagem a seguir ilustra a mudança de volume (V) de um gás, dentro de um cilindro, por ação de uma pressão externa (p), identificada por meio da variação de altura (Δh).
→ Elasticidade
É a capacidade de um material retornar à sua forma original após ser deformado por uma força. Um exemplo é uma mola, que se estica quando puxada e volta à sua forma inicial ao ser solta. A imagem a seguir demonstra a deformação de uma mola por adição de pesos sobre ela.

→ Indestrutibilidade
É o princípio fundamental de que a matéria não pode ser destruída, apenas transformada. Esse conceito está fundamentado na Lei da Conservação da Massa, proposta por Antoine Lavoisier, que estabelece que "na natureza, a massa total de um sistema fechado permanece constante durante uma transformação física ou química".
Um exemplo desse princípio é a combustão do metano (CH4), que reage com o gás oxigênio (O2) e se transforma em gás carbônico (CO2) e água (H2O), como mostra a imagem a seguir.
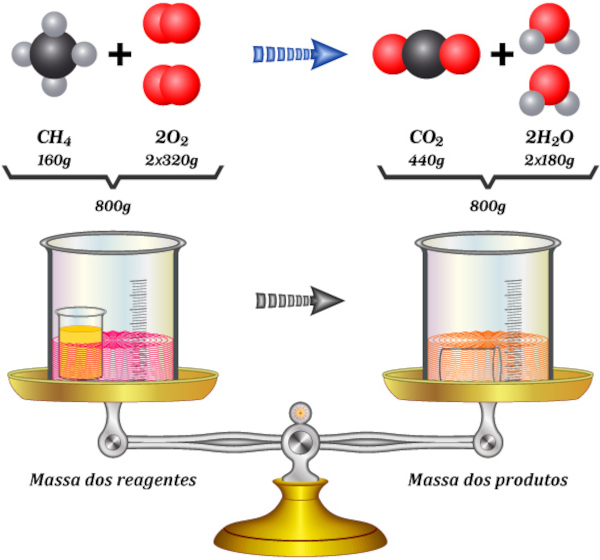
Todos os produtos resultantes da combustão somam a mesma massa que o gás metano e o oxigênio utilizados, evidenciando que a matéria foi apenas transformada, mas não destruída.
→ Descontinuidade
Refere-se ao fato de que a matéria não é contínua, mas composta por partículas microscópicas e espaços vazios. Embora pareça uniforme ao olho humano, em nível microscópico a matéria é formada por moléculas, que, por sua vez, são formadas por átomos. Os átomos são formados por prótons, nêutrons e elétrons, que também são formados por partículas ainda menores.
Um exemplo prático desse conceito é o movimento browniano, observado ao colocar grãos de pólen sobre uma superfície de água. Sob o microscópio, os grãos se movem de forma aleatória devido ao impacto de partículas invisíveis de água, demonstrando que a matéria é formada por partículas individuais e não por um bloco contínuo.
Leia também: Reações químicas — como e de que forma acontecem?
Mudanças de estados físicos da matéria
As mudanças de estados físicos da matéria são processos nos quais a matéria passa de um estado de agregação para outro devido à absorção ou liberação de energia. Esses processos ocorrem porque a energia, geralmente na forma de calor, altera a interação entre as partículas que compõem a matéria, modificando sua organização estrutural e comportamento.
Os três principais estados físicos são:
-
Fase sólida: caracteriza-se pela organização regular das partículas, que estão dispostas de forma compacta e ordenada, resultando em uma forma e volume definidos. Por exemplo, o gelo é a fase sólida da água. Nesse estado, as partículas vibram em torno de posições fixas, com pouca liberdade de movimento.
-
Fase líquida: as partículas possuem maior liberdade de movimento em relação à fase sólida, mas ainda permanecem próximas umas das outras. A matéria líquida apresenta volume definido, mas sua forma adapta-se ao recipiente onde está contida. A água em estado líquido é um exemplo claro desse estado.
-
Fase gasosa: as partículas estão muito afastadas umas das outras e movem-se livremente, sem forma ou volume definidos. O gás ocupa completamente o recipiente que o contém, como o vapor d'água presente no ar.
A matéria pode se apresentar nessas diferentes fases de agregação, e as transições entre elas dependem da variação de temperatura e pressão.
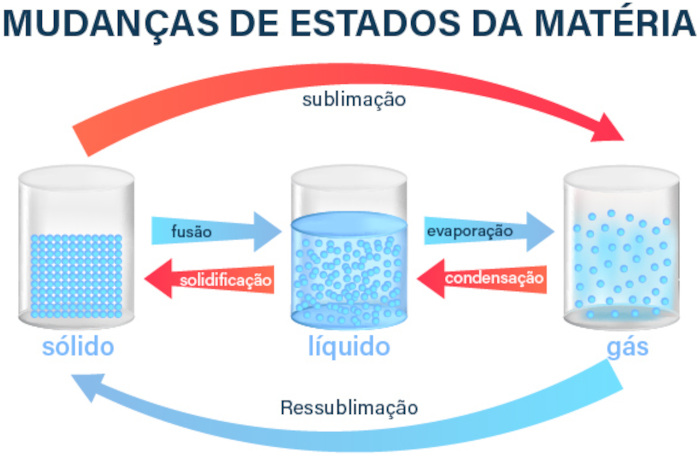
→ Fusão: é o processo de transição da fase sólida para a fase líquida. Durante a fusão, a matéria absorve energia térmica, que enfraquece as forças de ligação entre as partículas, permitindo que elas se movimentem mais livremente. Exemplo: o derretimento do gelo ao atingir 0 °C, ou seja, quando o gelo se transforma em água líquida.
→ Solidificação: é o processo inverso, em que a matéria passa da fase líquida para a fase sólida. Nesse caso, a matéria libera energia térmica, fortalecendo as interações entre as partículas e promovendo uma organização mais rígida. Exemplo: a formação de gelo quando a água líquida é resfriada abaixo de 0°C.
→ Vaporização: é a transição da fase líquida para a fase gasosa, que ocorre quando a matéria absorve energia suficiente para superar as forças de atração entre suas partículas. Esse processo pode ocorrer de três formas:
-
Evaporação: ocorre lentamente, apenas na superfície do líquido, e em temperaturas abaixo do ponto de ebulição. Exemplo: a evaporação de uma poça de água em um dia quente.
-
Ebulição: acontece de forma mais rápida, em toda a massa líquida, quando o líquido atinge seu ponto de ebulição. Exemplo: a fervura da água a 100°C ao nível do mar.
-
Calefação: é a vaporização extremamente rápida que ocorre quando um líquido entra em contato com uma superfície muito quente. Exemplo: o som de "chiado" e o surgimento de bolhas ao se derramar água em uma frigideira aquecida.
→ Condensação: é o processo de mudança da fase gasosa para a fase líquida, causado pela liberação de energia térmica, que diminui a energia cinética das partículas e favorece a formação de ligações intermoleculares. Exemplo: o orvalho que se forma pela manhã em superfícies frias, como folhas de plantas, ocorre devido à condensação do vapor d'água presente no ar.
→ Sublimação: é a mudança direta do estado sólido para o estado gasoso, sem passar pela fase líquida. Esse processo ocorre quando a matéria absorve energia suficiente para superar completamente as forças de atração entre as partículas no estado sólido. Exemplo: o gelo-seco (dióxido de carbono sólido) sublimando em temperaturas normais, liberando gás carbônico diretamente para o ambiente.
→ Ressublimação: é o processo inverso, em que a matéria passa diretamente do estado gasoso para o sólido, liberando energia térmica. Exemplo: a formação de geada em noites frias, quando o vapor d'água do ar se transforma diretamente em cristais de gelo sobre superfícies expostas.
Quais as diferenças entre propriedades gerais e propriedades específicas da matéria?
As propriedades gerais da matéria são comuns a todos os tipos de materiais, como extensão, inércia e impenetrabilidade. Já as propriedades específicas distinguem as substâncias entre si e dependem de sua composição química e estrutura física. Exemplos incluem densidade, calor específico, condutividade térmica e elétrica, entre outras. Para saber mais sobre as propriedades específicas, clique aqui.
Exercícios sobre propriedades gerais da matéria
Questão 1
(UGF-RJ) O aquecimento global já apresenta sinais visíveis em alguns pontos do planeta. Em uma ilha do Alasca, na aldeia de Shishmaref, por exemplo, as geleiras já demoram mais a congelar no inverno; descongelam mais rápido na primavera; e há mais icebergs. Desde 1971, a temperatura aumentou, em média, 2 °C.
As mudanças de fases descritas no texto são, respectivamente,
A) solidificação e fusão.
B) solidificação e condensação.
C) sublimação e solidificação.
D) solidificação e ebulição.
E) fusão e condensação.
Resolução:
A resposta correta é: A) solidificação e fusão.
Vamos analisar cada parte da questão:
-
"Geleiras já demoram mais a congelar no inverno": isso se refere à mudança de estado da água do estado líquido (água) para o estado sólido (gelo), ou seja, à solidificação. Como o processo está demorando mais, significa que a solidificação está ocorrendo em uma temperatura mais elevada do que o normal.
-
"Descongelam mais rápido na primavera": o gelo está se transformando em água líquida, o que corresponde à mudança de estado sólido para líquido, ou seja, à fusão. A ocorrência mais rápida da fusão indica que a temperatura está mais elevada, facilitando a mudança de fase.
As demais alternativas estão incorretas porque:
-
B) solidificação e condensação: A condensação é a passagem do estado gasoso para o líquido, não se aplicando ao processo descrito.
-
C) sublimação e solidificação: A sublimação é a passagem direta do estado sólido para o gasoso ou vice-versa, sem passar pelo estado líquido.
-
D) solidificação e ebulição: A ebulição é a passagem do estado líquido para o gasoso, não se aplicando ao contexto das geleiras.
-
E) fusão e condensação: A fusão está correta, mas a condensação, como já mencionado, não se aplica ao processo descrito.
Questão 2: Um grupo de estudantes desenvolveu um experimento para medir diferentes propriedades de um material. Na demonstração do experimento, eles verificaram que a amostra apresentava resistência a alterações no seu estado de repouso ou movimento, ocupava um volume específico no espaço e poderia ser subdividida em partes menores.
Com base nessa descrição, quais são as propriedades gerais da matéria mencionadas respectivamente?
A) Massa, elasticidade e indestrutibilidade.
B) Inércia, extensão e divisibilidade.
C) Compressibilidade, ponto de fusão e impenetrabilidade.
D) Extensão, densidade e inércia.
E) Elasticidade, inércia e compressibilidade.
Resolução:
A resposta correta é: B) Inércia, extensão e divisibilidade.
No enunciado, a descrição indica que o material:
-
resiste a alterações no estado de repouso ou movimento, que é a definição de inércia;
-
ocupa um volume específico no espaço, que corresponde à propriedade de extensão;
-
pode ser subdividido em partes menores, característica da divisibilidade.
Fontes
BROWN, Theodore L. et al. Química: a ciência central. 9.ed. São Paulo: Prentice Hall, 2005.
CHANG, Raymond; Química Geral: Conceitos Essenciais; 4ªed.; São Paulo;McGraw-Hill;2007.