Polaridade de Ligações Covalentes
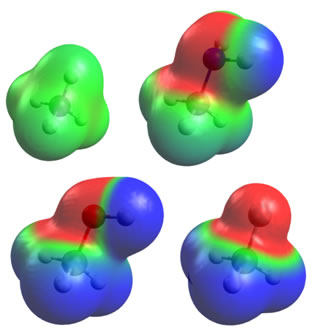
As ligações covalentes podem ser apolares ou polares. Depende do tipo de elemento que realiza a ligação. Por exemplo, o Cl2 apresenta a seguinte ligação covalente:
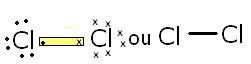
Esse par eletrônico compartilhado origina uma nuvem eletrônica que se distribui em torno dos átomos, conforme ilustrado abaixo:
Observe que a distribuição dessa nuvem é uniforme, porque os dois átomos são iguais e, portanto, apresentam a mesma eletronegatividade.
| Eletronegatividade é a capacidade de o átomo atrair, na sua direção, o par de elétrons que ele está compartilhando com outro átomo. |
Esse tipo de ligação, que não apresenta diferença de eletronegatividade, ou de polaridade, é denominado ligação apolar.
Agora observe o caso de ligação covalente abaixo, que é realizada entre átomos de elementos diferentes, o hidrogênio e o cloro, formando o gás clorídrico:

O cloro é mais eletronegativo que o hidrogênio, por isso a nuvem eletrônica é deslocada na sua direção, criando uma diferença de polaridade, que é representada pela letra delta (δ). O polo negativo, que é, no caso, o cloro, é representado por δ-; e, o polo positivo, que é o hidrogênio, é representado por δ+. Observe essa diferença na ilustração abaixo:
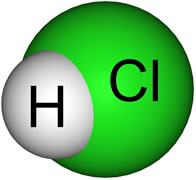
Esse tipo de ligação, em que ocorre diferença de polaridade ou eletronegatividade, é denominado ligação polar.
Se o hidrogênio se ligasse com o flúor, no lugar do cloro, essa diferença de polaridade se intensificaria, pois o flúor é mais eletronegativo que o cloro.
| Assim, quanto maior for a eletronegatividade, maior será a polarização da ligação. |
Essa polaridade de cada molécula pode ser medida pela diferença de eletronegatividade (?), ou seja, pela diminuição da eletronegatividade dos átomos dos elementos envolvidos na ligação. Observe como isso é feito abaixo:
Cl—Cl
3,0 3,0 → ? = 3,0 – 3,0 → ? = 0 (apolar)
H—Cl
2,1 3,0 → ? = 3,0 – 2,1 → ? = 0,9 (polar)
H—F
2,1 4,0 → ? = 4,0 – 2,1 → ? = 1,9 (caráter polar ainda mais acentuado)
Se esse valor ultrapassar 1,7, a ligação deixa de ter caráter covalente e passa a ser iônica, porque a atração do elemento sobre o par eletrônico é tão grande que a ligação covalente se rompe, tornando-se uma ligação iônica.
A única exceção é o HF, que é um composto covalente apesar de ter a diferença de eletronegatividade maior que 1,7.
Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias


















