Equações químicas
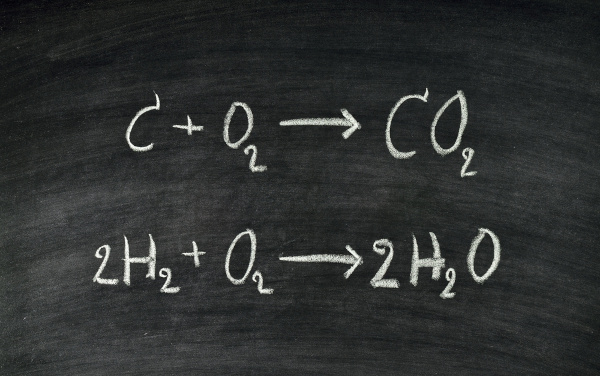
As equações químicas são formas de representar reações químicas de forma universal. Nessa representação, os reagentes e produtos são separados por uma seta, em que os reagentes são dispostos do lado esquerdo, enquanto os produtos estão do lado direito da seta. As substâncias são identificadas por seus símbolos e fórmulas moleculares.
As equações químicas possuem uma simbologia própria, utilizada para tentar reproduzir o maior número de condições possível do processo químico. Podem ser utilizadas para representar reações inorgânicas ou orgânicas, com a presença de íons ou não. Como as reações químicas observam leis de conservação de massa e conservação de carga, as equações químicas devem ser devidamente balanceadas.
Leia também: O que pode alterar a velocidade de uma reação química?
Resumo sobre equações químicas
- Equações químicas são representações de reações químicas.
- Nas equações químicas, os reagentes e os produtos são separados por uma seta, sendo os reagentes dispostos do lado esquerdo e os produtos do lado direito.
- Diversos símbolos podem ser usados nas equações químicas com o intuito de melhor reproduzir as condições das reações químicas.
- As equações químicas podem reproduzir tanto reações inorgânicas quanto orgânicas.
- As equações químicas devem ser balanceadas, para respeitar os princípios de conservação de massa e eletroneutralidade das reações químicas.
Como as equações químicas são representadas?
Equações químicas são representações de reações químicas, em que os reagentes são dispostos no lado esquerdo e os produtos, no lado direito.
REAGENTES → PRODUTOS
Os participantes são representados por seus respectivos símbolos ou fórmulas moleculares. Antes de cada participante, números podem ser colocados para indicar os chamados coeficientes estequiométricos, que indicam a proporção mínima e inteira de mols que participam do processo químico.
Símbolos das equações químicas
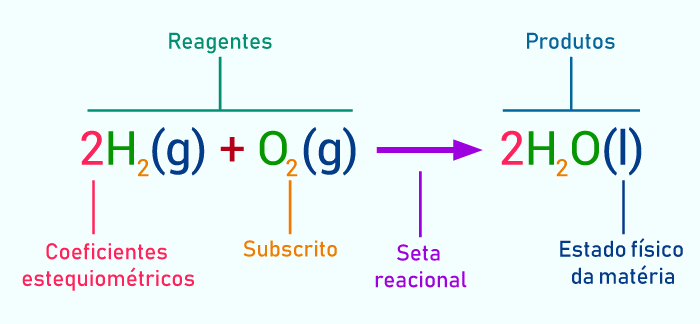
Sendo uma representação direta das reações químicas, as equações químicas contam com símbolos, os quais são universais e padronizados, de modo que qualquer pessoa, de qualquer lugar do mundo, entenda a equação. Os estados físicos das substâncias participantes são representadas por:
- (s) para sólidos;
- (l) para líquidos;
- (g) para gases;
- (aq) para solução aquosa.
O lado esquerdo (reagentes) e direito (produtos) de uma equação química é separada por uma seta. A depender do tipo de seta, podemos interpretar que:
- →: a reação só se propaga em uma única direção, que é o sentido direto.
- ⇌: a reação se propaga em ambos os sentidos, sendo reversível. Comumente aplicada em equações que representam equilíbrios químicos.
Informações complementares na equação acerca das condições reacionais também podem estar presentes. Tais símbolos podem estar sobre a seta da equação ou ao lado de um participante específico:
- cat.: indica a presença de um catalisador na reação. Representa-se sobre a seta da equação. Por vezes, é possível identificar o catalisador escrevendo a sua fórmula molecular. Por exemplo, se o catalisador for o AlCl3, pode-se escrever a fórmula do AlCl3 sobre a seta em vez de “cat.”.
- Δ: indica a presença de aquecimento na reação, ou seja, que a reação necessita de alta temperatura. É representado sobre a seta da equação.
- hν ou λ: indica que a reação necessita de luz para ocorrer. Representa-se sobre a seta da equação.
- H+: indica que a reação ocorre em meio ácido. Representa-se sobre a seta da equação.
- OH−: indica que a reação ocorre em meio básico. Representa-se sobre a seta da equação.
- [O]: indica a presença de um agente oxidante. Representa-se sobre a seta da equação. Assim como no caso dos catalisadores, é possível indicar, no lugar do símbolo, a fórmula molecular do agente oxidante. Por exemplo, se o agente oxidante for KMnO4, pode-se escrever a fórmula KMnO4 sobre a seta da equação.
- ↑: indica que o produto formado é volátil, desprendendo-se do meio reacional como gás. É representado ao lado da fórmula da substância.
- ↓: indica que o produto formado precipitou (tornou-se corpo de fundo). É representado ao lado da fórmula da substância.
Veja também: Como calcular a velocidade média de uma reação química
Quais são os tipos de equações químicas?
As equações químicas podem representar todos os tipos de reações químicas, sejam elas inorgânicas ou orgânicas. As substâncias envolvidas podem também ser neutras ou carregadas. Veja alguns exemplos:
- Equação de reações inorgânicas: os participantes envolvidos são compostos inorgânicos.
2 H2 (g) + O2 (g) → 2 H2O (g)
- Equação de reações orgânicas: os participantes envolvidos são compostos orgânicos.
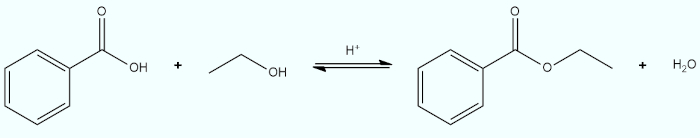
- Equação de reações com compostos iônicos: os participantes são íons (cátions ou ânions).
Ag+ (aq) + I− (aq) ⇌ AgI (s)
Balanceamento das equações químicas
As reações químicas obedecem a algumas leis, entre elas a lei da conservação das massas (lei de Lavoisier). Assim sendo, a massa dos reagentes utilizados deve ser igual à dos produtos gerados. Em uma equação química, para certificar que a lei da conservação das massas está sendo obedecida, é realizado o balanceamento da equação.
O balanceamento consiste em acertar os coeficientes estequiométricos de cada substância presente na equação, obedecendo à conservação de massa. Lembrando que os coeficientes são os números que aparecem antes das substâncias, sendo proibida a alteração dos números subscritos das substâncias para fins de balanceamento, pois isso acarretaria uma alteração da composição química das espécies participantes.
Por vezes a determinação dos coeficientes é muito fácil e direta, como no exemplo a seguir:
Zn + HCl → ZnCl2 + H2
Como é possível perceber, há apenas um átomo de hidrogênio e um átomo de cloro como reagentes, unidos na substância HCl. Porém, ao se observar os produtos, há dois átomos de cloro (no ZnCl2) e mais dois átomos de hidrogênio (no H2). Assim sendo, fica evidente a utilização de um coeficiente estequiométrico igual a 2 antes do HCl:
Zn + 2 HCl → ZnCl2 + H2
→ Balanceamento de equações por tentativas
Por vezes esse balanceamento não é tão claro e direto, e para isso podemos usar algumas estratégias. Uma delas é conhecida como o “método das tentativas”, que consiste em ir acertando os coeficientes estequiométricos até o sucesso. Contudo, escolher aleatoriamente valores para coeficientes nem sempre é fácil, e para tal algumas técnicas existem.
A mais famosa e difundida é a chamada “Regra do MACHO”, cujo acrônimo sugere uma ordem de balanceamento: Metal, Ametal, Carbono, Hidrogênio e Oxigênio.
Vejamos o caso da seguinte reação:
NaOH + H2CO3 → Na2CO3 + H2O
O metal presente é o sódio (Na). Percebe-se que antes da seta há apenas um átomo de sódio, enquanto após a seta há 2 átomos no Na2CO3. Para balanceamento, coloca-se o coeficiente estequiométrico 2:
2 NaOH + H2CO3 → Na2CO3 + H2O
Seguindo o balanceamento, há o carbono como ametal, além de hidrogênio e oxigênio. Contudo, pela regra do MACHO, esses elementos têm seu próprio momento para serem corrigidos. Não havendo outro ametal, analisa-se o carbono.
Percebe-se que o carbono já está balanceado, pois o número de carbonos é igual antes e após a seta (H2CO3 e Na2CO3). Já o hidrogênio não. Há 2 átomos de hidrogênio no NaOH (o coeficiente estequiométrico varia a quantidade de todos os elementos da substância) e mais 2 átomos no H2CO3, totalizando 4 átomos de hidrogênio antes da seta. Como só há 2 átomos de hidrogênio na água (produto), fazemos a correção com o coeficiente estequiométrico 2:
2 NaOH + H2CO3 → Na2CO3 + 2 H2O
Por fim, o oxigênio. Percebe-se que há 5 átomos de oxigênio antes da seta (2 no NaOH e mais 3 no H2CO3). Tal número é idêntico ao número de átomos de oxigênio nos produtos (3 no Na2CO3 e mais 2 na H2O). Assim sendo, pode-se dizer que o oxigênio já está balanceado. Como ele foi o último elemento a ser observado e todos os demais já foram confirmados como balanceados, pode-se então concluir que a equação está devidamente balanceada.
2 NaOH + H2CO3 → Na2CO3 + 2 H2O
→ Balanceamento redox
Além da conservação de massa, uma reação química também conserva sua carga elétrica total. Assim sendo, há uma metodologia de balanceamento de equação que se baseia na conservação da carga, conhecida como balanceamento redox.
Por exemplo:
Cu (s) + Ag+ (aq) → Cu2+ (aq) + Ag (s)
Em um primeiro momento parece que está tudo certo em termos de massa, contudo percebe-se que o somatório das cargas totais nos reagentes (+1) é diferente do somatório das cargas totais nos produtos (+2). Por isso, o acerto dessas cargas é feito da seguinte forma:
Cu (s) + 2 Ag+ (aq) → Cu2+ (aq) + 2 Ag (s)
Algumas reações em que todas as espécies são neutras também podem ser balanceadas pelo método redox. Nesse caso, verifica-se a variação das cargas dos elementos ao longo do processo químico. Por exemplo:
Fe + AgCl → FeCl3 + Ag
O ferro (Fe) inicia o processo químico com uma carga igual a 0, terminando com uma carga igual a +3 no FeCl3. A prata inicia o processo químico com uma carga igual a +1, terminando-o com uma carga igual a 0.
Se o Fe passou de 0 para +3, é sinal de que ele perdeu 3 elétrons (sofreu oxidação). Já Ag, se passou de +1 para 0, é sinal de que ganhou 1 elétron (sofreu redução). Como o número de elétrons perdidos deve ser igual ao de elétrons ganhados (eletroneutralidade do processo), os coeficientes estequiométricos são colocados para acertar o número de elétrons. Assim, coloca-se um coeficiente 3 em todas as espécies de prata para triplicar a quantidade de elétrons ganhados, igualando-se ao número de elétrons perdidos pelo ferro.
Fe + 3 AgCl → FeCl3 + 3 Ag
A metodologia a ser utilizada vai depender muito da situação. Na maioria das vezes o método das tentativas é suficiente, mas há casos específicos em que é melhor utilizar o método redox.
→ Videoaula sobre balanceamento das equações químicas

Exercícios resolvidos sobre equações químicas
Questão 1. (Unioeste/2024) O ouro em nível elevado de pureza é utilizado na produção de chips de computador. Um processo de refino do ouro em que ele reage com cloro em meio ácido é mostrado na equação a seguir.
Faça o balanceamento dessa equação de modo a determinar os coeficientes estequiométricos abaixo e assinale a alternativa que apresenta a sequência CORRETA dos mesmos.
x Au + y Cl2 + z HCl → w HAuCl4
(A) x = 1; y = 2; z = 2; w = 1.
(B) x = 2; y = 1; z = 2; w = 2.
(C) x = 2; y = 2; z = 3; w = 2.
(D) x = 2; y = 3; z = 3; w = 2.
(E) x = 2; y = 3; z = 2; w = 2.
Resposta: Letra E
Pela regra do MACHO, inicia-se pelo ouro (Au). Ele já está balanceado.
Depois, o cloro (ametal). Há 4 átomos de cloro em HAuCl4, mas há apenas 3 nos reagentes, sendo 2 no Cl2 e mais 1 no HCl. Assim, coloca-se o número 2 no HCl.
Au + Cl2 + 2 HCl → HAuCl4
O problema é que, ao colocar o 2 no HCl, deve-se também colocar um 2 no HAuCl4, a fim de se acertar o hidrogênio. Isso vai ocasionar em uma nova rodada de balanceamento, pois os átoms de ouro e cloro tiveram suas quantidades alteradas (de 1 para 2, no caso do Au, e de 4 para 8, no caso do Cl).
Au + Cl2 + 2 HCl → 2 HAuCl4
Por isso, agora, coloca-se um 2 na frente do Au. No caso do cloro, para não gerar uma nova rodada de balanceamento, acerta-se a quantidade apenas pelo Cl2, uma vez que essa substância não tem hidrogênio. Por isso, já havendo 2 átomos de cloro no HCl, faltam 6 átomos para chegar aos 8 presentes no HAuCl4. Por isso, usa-se o coeficiente estequiométrico 3 para o Cl2.
Assim, a reação fica: 2 Au + 3 Cl2 + 2 HCl → 2 HAuCl4
Questão 2. (Uesb 2º dia/2023) A reação de decomposição do óxido de prata (I), quando aquecido, produz prata metálica e gás oxigênio.
Diante dessa informação, assinale a alternativa que descreve essa reação devidamente balanceada.
(A) AgO (s) ⟶ Ag (s) + O (g)
(B) 2 AgO (s) ⟶ 2 Ag (s) + O2 (g)
(C) Ag2O (s) ⟶ 2 Ag (s) + O (g)
(D) 2 Ag2O (s) ⟶ 4 Ag (s) + O2 (g)
(E) Ag2O (s) ⟶ 2 Ag (s) + O2 (g)
Resposta: Letra D.
O óxido de prata (I) corresponde ao Ag2O. A questão diz que sua decomposição produz prata metálica, Ag, e gás oxigênio, O2. A reação é, então:
Ag2O (s) → Ag (s) + O2 (g)
Fazendo o balanceamento, acerta-se a quantidade de prata:
Ag2O (s) → 2 Ag (s) + O2 (g)
Contudo, há dois oxigênios no produto (em O2), e, para isso, coloca-se então um coeficiente 2 na frente do Ag2O:
2 Ag2O (s) → 2 Ag (s) + O2 (g)
Isso quebra o balanceamento anterior da prata, corrigindo-se com a substituição do coeficiente 2 para 4:
2 Ag2O (s) → 4 Ag (s) + O2 (g)
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
INTERNATIONAL OF PURE AND APPLIED CHEMISTRY – IUPAC. Compendium of Chemical Terminology – IUPAC Recommendations (Gold Book). Disponível em: < https://goldbook.iupac.org/
Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias


















