Pressão dos gases
Visto que as moléculas dos gases estão em contínua movimentação desordenada, elas se chocam com as paredes do recipiente que as contém, assim a intensidade dessa força por unidade de área das paredes dá o valor da pressão exercida pelo gás.
A Terra está envolvida por uma camada de ar com espessura de aproximadamente 800 km; e, em razão da gravidade, as camadas superiores comprimem as que estão embaixo. Assim, a pressão exercida pelos gases presentes na atmosfera sobre uma unidade de área de determinada superfície nos fornece a pressão atmosférica.
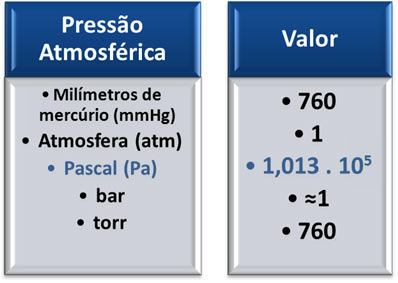
O primeiro cientista a medir o valor da pressão atmosférica ao nível do mar foi Evangelista Torricelli (1608-1647). Ele inverteu um tubo preenchido de mercúrio (Hg) sobre um recipiente contendo o mesmo líquido e observou que o mercúrio não escoava completamente: ficava um espaço vazio depois que o mercúrio escoava até a altura de 760mm.

Desse modo, a pressão ao nível do mar passou a ser equivalente a 760 mmHg. Abaixo temos as conversões para outras unidades usadas para pressão. No entanto, lembre-se de que a unidade do SI (Sistema Internacional de Unidades) é o Pascal (Pa), que é a mesma coisa que a força de 1 N aplicada em 1 m2 de área. Em outras palavras, 1 Pa é igual a 1N/m2.
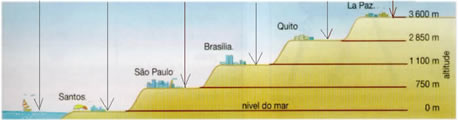
No entanto, esses valores são apenas ao nível do mar. Se variarmos o lugar em que se realiza o experimento de medição da pressão atmosférica, veremos que a pressão varia com a altitude de modo inversamente proporcional, ou seja:

Isso ocorre porque em regiões de grande altitude há uma menor quantidade de partículas do ar por unidade de volume, por isso a pressão será menor. Quanto maior for o número de partículas, mais colisões acontecerão e a pressão exercida será maior.