Gases
Gases são substâncias que estão no estado físico gasoso da matéria e que têm como principal característica a existência de grandes espaços vazios entre as partículas. Em razão disso, as moléculas que compõem os gases interagem muito pouco umas com as outras.
Em razão da reduzida interação entre as partículas, os gases não possuem forma e volume definidos e ocupam totalmente qualquer recipiente que os contenha. Os gases são altamente compressíveis e possuem menor densidade em comparação a líquidos e sólidos.
Alterações de pressão, temperatura e volume de um sistema interferem no comportamento dos gases, sendo tais mudanças previstas pela equação dos gases ideais, em que se assume a ausência de interações intermoleculares sob condições de alta temperatura e baixa pressão.
Saiba mais: Qual é o estado físico do fogo?
Resumo sobre gases
-
Gás é um dos estados físicos da matéria.
-
Nos gases, há grandes espaços vazios entre as partículas.
Não pare agora... Tem mais depois da publicidade ;) -
As partículas gasosas possuem alta energia cinética, movimentando-se contínua e desordenadamente.
-
As moléculas gasosas interagem de forma reduzida entre si.
-
As propriedades dos gases se devem à reduzida interação entre as partículas.
-
Gases não possuem forma e volume definidos e se espalham por todo o recipiente que os contém.
-
Os gases são facilmente compressíveis e são menos densos do que sólidos e líquidos.
-
Os gases formam misturas homogêneas com outros gases.
-
O modelo dos gases perfeitos ou ideais assume a inexistência de interações entre as partículas gasosas em condições de elevada temperatura e baixa pressão.
-
A equação dos gases ideais ou equação de Clapeyron descreve o comportamento dos gases mediante alterações de pressão, temperatura e volume e reúne as leis de Boyle, de Gay-Lussac e de Charles.
Videoaula sobre gases
O que são gases?
Gases é o nome dado às substâncias que se encontram no estado físico da matéria conhecido como gás.
Nos gases, há um grande espaço vazio entre as moléculas, resultando em uma reduzida interação entre elas. Esse é o principal aspecto que os caracteriza, explicando suas propriedades e os diferenciando dos outros estados físicos da matéria.
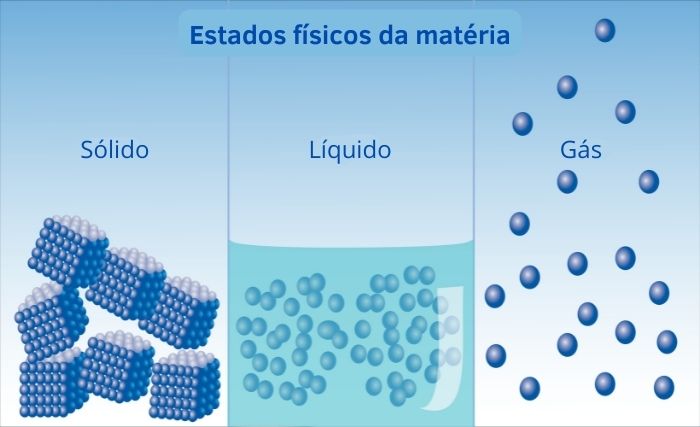
Em sólidos e líquidos, as interações intermoleculares são mais intensas em razão de as partículas estarem mais próximas umas das outras, comportamento crucial para a determinação das propriedades da substância.
Os gases podem ser reconhecidos por algumas propriedades características, como não possuir forma e volume fixos, ocupando totalmente qualquer recipiente que os contenha.
Quais são as características dos gases?
As propriedades singulares apresentadas pelos gases são explicadas pelo espaço existente entre as suas partículas e, consequentemente, pela reduzida interação entre elas. Veja cada uma delas a seguir.
-
Expansibilidade
Os gases não mantêm forma fixa nem volume estabelecido, de modo que podem preencher todo o espaço que ocupam, até que encontrem algum tipo de barreira física. Essa propriedade é conhecida como expansibilidade.

-
Compressibilidade
Os gases são facilmente compressíveis, possuindo então alta compressibilidade. Como há muito espaço livre entre as suas moléculas, quando submetidos à pressão, o volume ocupado pelo gás pode ser reduzido de forma considerável. As partículas gasosas respondem à compressão pela elevação da pressão exercida sobre as paredes do recipiente.
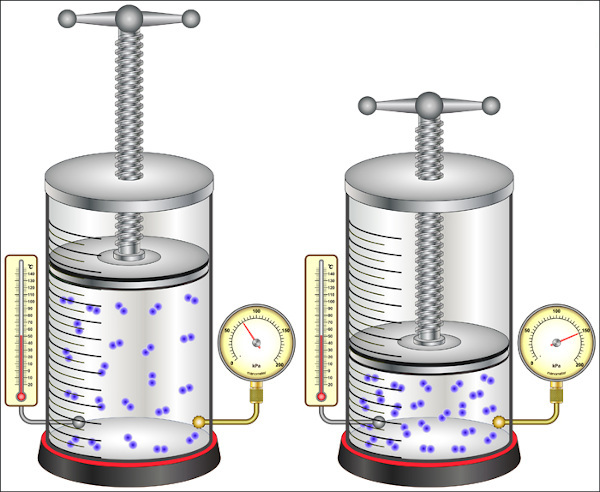
Interessante: Enquanto os gases possuem alta compressibilidade, os sólidos e líquidos têm uma capacidade de compressibilidade extremamente reduzida.
-
Pressão
As partículas de um gás estão em constante movimentação dentro do recipiente que as contém, por isso uma fração delas está continuamente se chocando com as paredes do recipiente.
Tais colisões exercem uma força sobre a parede do frasco. Ao considerar todas as colisões que ocorrem em determinada área da parede, obtém-se a pressão exercida pelo gás. Os choques de partículas contra a parede do frasco são considerados elásticos, isso significa que as moléculas não perdem energia e velocidade durante as colisões.

A pressão exercida por um gás é usada como uma medida da concentração do gás naquele recipiente.
-
Densidade
Em razão de não manterem um volume definido, os gases não possuem um valor fixo de densidade. Sua densidade se altera de modo inversamente proporcional ao volume ocupado por eles.
Como a densidade é definida pela relação entre massa e volume, os gases possuem menor densidade do que líquidos e sólidos. Afinal, determinada massa de uma substância no estado gasoso sempre ocupará maior volume do que no estado líquido, em razão do maior espaçamento entre as partículas.
-
Difusão
Difusão gasosa é a capacidade dos gases de se espalharem de forma espontânea em outro gás, sempre formando misturas homogêneas, independentemente da proporção em que são misturados. Ao contrário do observado para os líquidos, em que há casos de imiscibilidade ou de miscibilidade parcial.
-
Agitação térmica
As partículas dos gases se movimentam de forma contínua e desordenada, mantendo uma elevada energia cinética. Essa movimentação constante de suas partículas é chamada de agitação térmica e é diretamente proporcional à temperatura.
Ao fornecer-se calor ao sistema, as partículas têm sua energia cinética aumentada e se movimentam com mais velocidade. Ao reduzir-se a temperatura, as moléculas se tornam mais lentas e sua energia cinética diminui.
-
Dilatabilidade
As partículas gasosas estão em constante movimentação. Ao receberem calor por meio da elevação de temperatura, a energia cinética das partículas aumenta, elevando a agitação térmica.
Com esse estímulo, as moléculas passam a se movimentar mais rapidamente, aumentando a pressão exercida na parede de um frasco ou o volume ocupado pelo gás, fenômeno conhecido como dilatação. Assim, as partículas de um gás possuem dilatabilidade.
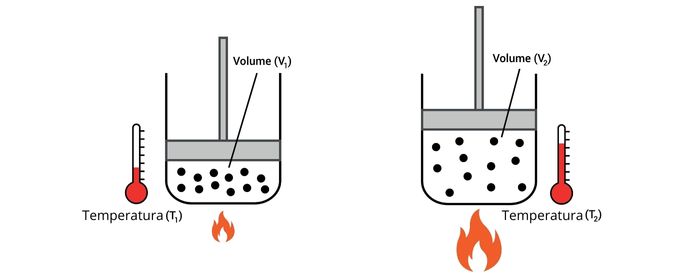
Comportamento dos gases
Os gases, assim como outras substâncias, apresentam propriedades químicas diferentes em função de sua composição. Contudo, eles possuem um comportamento interessante e distinto de sólidos e de líquidos. Ao submeter diferentes gases às condições de elevadas temperaturas e de baixas pressões, eles passam a manifestar comportamentos muito similares entre si, independentemente de sua composição.
Aproveitando essa característica, foi criado um modelo teórico de estudo para os gases conhecido como “modelo dos gases ideais” ou “modelo dos gases perfeitos”. Segundo ele, diferentes gases passam a apresentar propriedades muito semelhantes quando submetidos a altas temperaturas e baixas pressões. Ainda, sob tais condições, a energia cinética das partículas é muito alta e as interações intermoleculares se tornam desprezíveis.
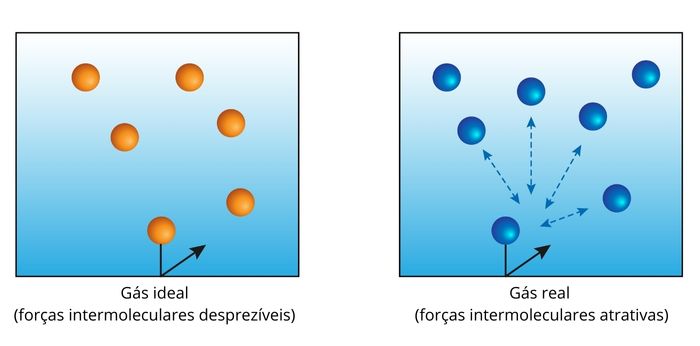
Esse modelo que despreza as forças intermoleculares é uma simplificação teórica e não ocorre na realidade, mas é uma ferramenta importante para entender o funcionamento dos gases. O modelo dos gases ideais será mais eficiente quanto maior for a temperatura e menor for a pressão.
Sob condições de elevada pressão ou de baixa temperatura, o modelo dos gases ideais deixa de funcionar, pois as forças de interação entre partículas se tornam maiores do que a própria energia cinética de cada uma delas, e o sistema passa a ser considerado real.
Saiba mais: Lei de Graham — a lei que se preocupa com a velocidade de difusão e de efusão de um gás
Equação geral dos gases, a equação de Clapeyron
Com base na descoberta e na investigação das propriedades químicas dos gases, alguns estudiosos que viveram entre os séculos XVII a XIX foram responsáveis pela elaboração de leis empíricas que descrevem o comportamento dos gases em função das variações de pressão (P), temperatura (T) e volume (V).
Tais leis ― elaboradas por Robert Boyle, Jacques Chales e Gay-Lussac ― podem ser expressas por relações matemáticas. Ao combinar-se as contribuições individuais desses três cientistas com a ideia de quantidade de matéria introduzida com base no conceito de mol (por Amedeo Avogadro), uma relação de proporcionalidade entre as variáveis de pressão, temperatura e volume é encontrada para gases com comportamento ideal:
\(pV\propto\ nT\)
Essa relação de proporcionalidade se torna uma igualdade quando considerada a constante universal dos gases ideais (R). Como o nome sugere, essa constante é válida para todos os gases quando estão sob condições de idealidade, isto é, com interações intermoleculares desprezíveis. O valor de R é igual a:
8,314 J K-1 mol-1
ou
0,082 atm L mol -1 K-1
Dessas relações matemáticas, deriva a conhecida equação geral dos gases perfeitos, ou equação de Clapeyron, disposta a seguir:
\({pV}={nRT}\)
A interpretação dessa relação informa que a pressão exercida por um gás ideal é diretamente proporcional à temperatura e ao número de mols de gases, ou seja, a pressão exercida pelo gás aumenta com o aquecimento e/ou com o maior número de moléculas no recipiente.
A equação de Clapeyron também informa que a pressão varia inversamente com o volume. Isso significa que, ao comprimir-se uma amostra gasosa, ou seja, diminuir o volume ocupado por ela, o sistema naturalmente responde com o aumento da pressão sobre as paredes do recipiente.
É importante perceber que essa relação matemática explica algumas das propriedades dos gases. A importância da equação de Clapeyron está em ser possível estimar a variação de uma das propriedades do gás, desde que se conheça as demais. Por exemplo, é possível calcular a variação de volume durante a dilatação de determinada amostra de gás ao ser aquecida.
-
Videoaula sobre equação geral dos gases
Fórmulas dos gases
A equação geral dos gases perfeitos foi determinada de forma empírica, isto é, experimentalmente, pela combinação das contribuições de três pesquisadores.
-
Lei de Boyle
Em seus estudos em laboratório em 1662, Robert Boyle concluiu que, em transformações isotérmicas ― ocorridas em temperatura constante ―, o produto entre o volume ocupado e a pressão exercida por um gás é sempre constante:
\({P}_{1}\ .{\ {V}}_{1}=\ {P}_{2}\ .{\ {V}}_{2}\)
-
Lei de Gay-Lussac
Em 1808, Louis Joseph Gay-Lussac concluiu em seus trabalhos que, em transformações gasosas conduzidas sem variação de volume ― transformação isovolumétrica ―, a relação entre pressão e temperatura se mantém constante, ocorrendo aumento da pressão durante o aquecimento:
\(\frac{P_1}{T_1}=\frac{P_2}{T_2}\)
-
Lei de Charles
Jacque Charles contribuiu para o estudo dos gases ao concluir, por meio de seus trabalhos em laboratório, em torno de 1787, que, ao se manter a pressão constante em transformações gasosas ― transformações isobáricas ―, o volume de uma amostra de gás se altera de modo proporcional à temperatura.
\(\frac{V_1}{T_1}=\frac{V_2}{T_2}\)
Importante: Cada uma dessas relações descreve uma característica do comportamento dos gases e pode ser aplicada na análise de transformações gasosas. A equação de Clapeyron reúne essas leis em uma única equação, descrevendo de maneira mais ampla o comportamento dos gases ideais.

