Teoria ácido-base de Brönsted-Lowry
De forma independente, dois químicos, o dinamarquês Johannes Nicolaus Brönsted (1879-1947) e o inglês Thomas Martin Lowry (1874-1936), propuseram no mesmo ano uma teoria sobre o conceito de ácidos e bases. A teoria anteriormente reconhecida, a teoria de Arrhenius, apesar de bem útil, era limitada a soluções aquosas; já a que eles criaram era mais abrangente. Essa teoria recebeu o nome de Teoria de Brönsted-Lowry:

Exemplo:
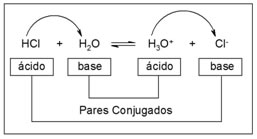
HCl + H2O → H3O++ Cl-
ácido base
Reação inversa:
H3O++ Cl- → HCl + H2O
ácido base
Nesta reação inversa, o íon hidrônio (H3O+) doou um próton para o íon cloreto (Cl-), assim o hidrônio é o ácido e o cloreto é a base de Brönsted. Forma-se o par ácido-base conjugado: HCl e Cl-; e um segundo par conjugado ácido-base : H2O e H3O+. Chama-se de par conjugado, porque em ambos os casos, um doa o próton e se transforma no outro: o HCl doa o próton e se transforma em Cl- e o H3O+doa o próton e se transforma em H2O.
Neste caso, o cloreto de hidrogênio atua como um ácido de Brönsted e a água como uma base de Brönsted, pois, quando gasoso, o cloreto de hidrogênio permanece intacto, mas quando dissolvido em água, o átomo de hidrogênio forma uma ponte de hidrogênio com o átomo de oxigênio de uma molécula de água e, desta forma, um próton (H+) migra para a molécula de água, que atua como a base porque recebeu o próton.
Diferentemente da teoria de Arrhenius, na de Brönsted-Lowry um ácido pode atuar como uma base, o conceito de ácido e base é relativo: dependem da espécie química com a qual a substância está reagindo para saber se ela é acida ou básica.
Por exemplo, no caso acima, a água foi a base, mas se ela estiver reagindo com a amônia, ela se comportará como o ácido, pois será protonada pela água, conforme a reação abaixo mostra:
NH3 + H2O → NH4+ + OH-
base ácido
Quando uma substância se comporta assim como a água, podendo ser ácido ou base, ela é chamada de substância anfótera.

