Funções inorgânicas
Funções inorgânicas são os grupos de substâncias químicas que não apresentam como elemento químico central o carbono (já que as substâncias que o apresentam pertencem às funções orgânicas), ou seja, fazem parte da Química Inorgânica. As principais são:
Leia também: Conceito de ácido, base e sal pela teoria de Arrhenius
Resumo sobre funções inorgânicas
- As funções inorgânicas classificam as substâncias inorgânicas em diferentes grupos, de acordo com as suas propriedades químicas.
- As principais funções inorgânicas são: ácido, base, sal e óxido.
- Os ácidos liberam íons H+ em contato com água.
- As bases liberam íons OH- em contato com água.
- Os sais são formados por um cátion diferente do íon H+ e um ânion distinto do íon OH-.
- Os sais são formados na reação entre um ácido e uma base.
- Os óxidos são compostos binários formados por oxigênio e um outro cátion.
- Hidretos, carbetos e sulfetos são outras classificações para compostos inorgânicos.
Videoaula sobre funções orgânicas
O que são funções inorgânicas?
As funções inorgânicas são os grupos em que se dividem os compostos inorgânicos, baseados nas similaridades entre as suas propriedades químicas e sua reatividade.
Os compostos inorgânicos são aqueles que não possuem o carbono como principal elemento, sendo formados por todos os demais elementos da tabela periódica. No entanto, há algumas exceções, como o CO2 e Na2CO3, que mesmo possuindo átomo de carbono são considerados substâncias inorgânicas devido às suas características.
Quais são as funções inorgânicas?
As principais funções inorgânicas são:
- ácidos,
- bases,
- sais e
- óxidos.
Há outras funções inorgânicas de menor relevância, por possuírem menor número de compostos. São elas:
- hidretos,
- carbetos e
- sulfetos.
• Ácido
A função inorgânica ácido engloba os compostos covalentes que sofrem ionização em água, gerando o íon H+ como único cátion.
Por exemplo, a espécie ácido clorídrico (HCl) é classificada como ácido porque sofre ionização em água, gerando cátion H+ e ânion Cl-:
\(HCl\ \left(aq\right)\longrightarrow\ H^+\left(aq\right)+\ {Cl}^-(aq)\)
A presença de íons em solução é condição para que ocorra condução de corrente elétrica. Logo, soluções aquosas ácidas conduzem eletricidade de forma proporcional à concentração de íons em solução.

Substâncias ácidas são solúveis em água, caracterizadas pelo sabor azedo e por registrarem valores de pH entre 0 e 7 na escala de pH.
Os ácidos podem ser classificados de acordo a força relativa, a quantidade de hidrogênios ionizáveis e a presença de oxigênio que possuem.
A força dos ácidos é medida em grau de ionização (α), que é a razão entre a quantidade de moléculas que efetivamente sofrem ionização pela quantidade total de moléculas em solução:
\(\alpha=\ \frac{número de moléculas ionizadas}{ número de moléculas dissolvidas}\)
Quanto maior o valor de α, mais forte é o ácido.
- Ácidos fortes possuem α superior a 50% (α > 0,5).
- Ácidos moderados possuem α entre 5% e 50% (0,05 < α < 0,5).
- Ácidos fracos possuem α inferior a 5% (α < 0,5).
Por exemplo, o ácido nítrico é um ácido forte porque possui α = 92%. Isso significa que, em uma solução constituída por 100 moléculas desse ácido, 92 moléculas sofrem ionização e formam íons H+, e apenas 8 delas se mantêm na forma não-ionizada.

Em relação à quantidade de hidrogênios que podem ser liberados em solução aquosa, chamados de hidrogênios ionizáveis, os ácidos são classificados em:
- Monoácidos: apenas um hidrogênio ionizável. Exemplos:
- Ácido clorídrico - HCl
- Ácido nítrico - HNO3
- Diácidos: dois hidrogênios ionizáveis. Exemplos:
- Ácido sulfúrico - H2SO4
- Ácido sulfídrico - H2S
- Triácidos: três hidrogênios ionizáveis. Exemplos:
- Ácido fosfórico - H3PO4
- Ácido bórico - H3BO3.
Alguns ácidos podem conter átomos de oxigênio, sendo denominados de oxiácidos, enquanto as espécies que não têm oxigênio são chamadas de hidrácidos.
-
Bases
A função inorgânica base engloba compostos iônicos que sofrem dissociação em água, gerando o íon OH- (hidroxila) como único ânion.
A espécie hidróxido de sódio (NaOH) é uma base porque sofre dissociação em água, liberando íons OH-:
\(NaOH\ \left(aq\right)\longrightarrow\ {Na}^+\left(aq\right)+\ {OH}^-(aq)\)
O cátion que forma a substância básica, geralmente, é de caráter metálico.
As soluções básicas conduzem corrente elétrica proporcionalmente à concentração dos íons, uma vez que liberam íons em contato com a água, formando soluções eletrolíticas.
Substâncias básicas possuem sabor adstringente, sensação parecida com a de comer uma fruta verde. Bases fazem parte da composição de produtos de limpeza, como a soda cáustica (NaOH), da produção de produtos farmacêuticos, fertilizantes, cosméticos e da indústria alimentícia.
Como são caracterizadas pela presença de íons OH-, as bases registram valores de pH superiores a 7.
As bases apresentam diferentes solubilidades em água, dependendo do cátion formador. Veja um resumo na tabela abaixo:
|
Solubilidade das bases |
Tipo de cátion |
|
Bases solúveis |
Metal alcalino (grupo 1) e amônio. Exemplo: NaOH, KOH, NH4OH. |
|
Bases parcialmente solúveis |
Metal alcalino terroso (grupo 2). Exemplo: Ca(OH)2, Sr(OH)2. |
|
Bases pouco solúveis |
Demais bases. Aquelas que não possuem em sua composição metais dos grupos 1 e 2. Exemplo: Fe(OH)3 e Ni(OH)2. |
As bases são classificadas de acordo com a sua força relativa e a quantidade de hidroxilas dissociáveis.
A força das bases é estimada com base em seu grau de dissociação (α), que é determinado pela quantidade de moléculas da base que efetivamente se dissociam, liberando íons OH- em solução aquosa:
\(\alpha=\ \frac{número de moléculas dissociadas} {número de moléculas dissolvidas}\)
Quanto maior o grau de dissociação, mais forte é a base.
- Bases fortes possuem α maior que 5% (α > 0,5).
- Bases fracas possuem α menor que 5% (α ≤ 0,5).
Por exemplo, o hidróxido de amônio (NH4OH) é uma base fraca porque tem α = 1,5%, ou seja, em uma solução formada por 100 moléculas dessa base, menos de duas moléculas sofrerão dissociação para gerar íons OH-, ficando a maior parte das moléculas de NH4OH na sua forma não dissociada.
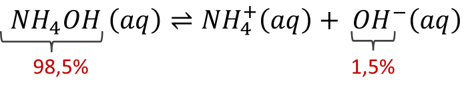
Em relação à quantidade de grupos de hidroxilas dissociáveis em solução aquosa, as bases são divididas em:
- monobases: uma única hidroxila dissociável. Exemplo:
- Hidróxido de sódio (NaOH).
- dibases: dois íons OH- dissociáveis. Exemplos:
- Hidróxido de cálcio (Ca(OH)2).
- tribases: três hidroxilas dissociáveis.
- Hidróxido de alumínio (Al(OH)3).
-
Sais
A função inorgânica sal reúne os compostos iônicos constituídos por um cátion diferente do íon H+ e um ânion distinto do íon OH-.
Os sais são formados por uma reação de neutralização envolvendo um ácido e uma base. Reações de neutralização geram como produtos sal e água. Veja a reação de formação do sal cloreto de sódio:
\(HCl+NaOH\ \longrightarrow NaCl+\ H_2O\)
Perceba que o sal formado não possui os íons H+ ou OH-.
A principal característica dos sais é o sabor salgado. Sais são substâncias sólidas, geralmente higroscópicas (absorvem água), que possuem elevadas temperaturas de fusão e de ebulição porque têm estrutura cristalina.
Sólidos cristalinos são muito duros e estáveis em razão de seus átomos assumirem forma geométrica bem estabelecida. Quando os sais são adicionados à água, sofrem dissociação formando uma solução eletrolítica, com capacidade de condução de corrente elétrica.
Os sais são substâncias abundantes na natureza, fazem parte da composição de rochas e minerais e são indispensáveis aos organismos vivos. O carbonato de cálcio (CaCO3), por exemplo, é o principal sal formador do mármore, da calcita, do calcário, fazendo parte da estrutura de cavernas, carapaças de animais marinhos, corais e cascas de ovos. O cloreto de sódio (NaCl) é o famoso sal de cozinha, utilizado na preparação e conservação de alimentos e em soros fisiológicos. Há muitos outros sais que possuem grande importância econômica por fazerem parte da fabricação de fármacos, fertilizantes, produtos de limpeza, indústria alimentícia, entre outros.
A solubilidade dos sais depende, principalmente, do ânion formador, mas grande parte deles são solúveis em água.
Os sais são classificados em neutros, ácidos ou básicos, conforme a reação de neutralização que os originou.
- Sais neutros: são produtos de uma reação de neutralização completa, em que todos os íons H+ se combinaram com íons OH-. Quando dissociado, o sal neutro não altera o pH do sistema.
- Sais ácidos ou hidrogenossais: são produtos de uma reação de neutralização parcial entre um ácido forte e uma base fraca, em que nem todos os íons H+ presentes no meio foram neutralizados. Quando dissociado, o sal ácido diminui o pH do sistema.
- Sais básicos ou hidroxissais: são produtos de uma reação de neutralização parcial entre um ácido fraco e uma base forte, em que nem todos os íons OH- presentes no meio foram neutralizados. Quando dissociado, o sal ácido eleva o pH do sistema.
• Óxidos
A função inorgânica óxido engloba os compostos formados por dois elementos químicos, sendo um deles o oxigênio.
Os óxidos moleculares possuem ligação covalente entre o oxigênio e um ametal, como o carbono (dióxido de carbono-CO2). Os óxidos iônicos mantêm ligação entre o oxigênio e um metal, como o ferro (hidróxido de ferro-Fe(OH)3).
Os óxidos são comuns no cotidiano, pois fazem parte da respiração animal e vegetal em razão do CO2. Eles são emitidos para a atmosfera durante processos de combustão, sob a forma de óxidos nitrosos. O óxido é o principal componente da ferrugem (Fe2O3). Alguns óxidos são usados em procedimentos industriais.

Os óxidos são agrupados segundo seu comportamento químico:
- Óxidos ácidos: compostos covalentes formados por oxigênio e um elemento ametal. Geram ácidos em contato com água e sofrem reação de neutralização com bases, formando sal e água como produtos. Exemplo: dióxido de carbono (CO2).
- Óxidos básicos: compostos iônicos formados por oxigênio e um elemento metálico. Geram bases em contato com água e sofrem reação de neutralização com ácidos, formando sal e água como produtos. Exemplo: óxido de cálcio (CaO).
- Óxidos anfóteros: apresentam resposta química diferente, dependendo do meio, ora atuando como óxido ácido, ora atuando como óxido básico. Exemplo: óxido de zinco (ZnO) e óxido de alumínio (Al2O3).
- Óxidos duplos ou mistos: possuem comportamento diferenciado, como se fossem formados por dois óxidos diferentes do mesmo elemento químico. Um exemplo clássico de óxido duplo é o tetróxido de ferro (Fe3O4), formado pelos óxidos FeO e Fe2O3.
- Óxidos neutros: possuem baixa reatividade; não sofrem transformações químicas ou não reagem com ácidos, bases ou água. Exemplo: monóxido de carbono (CO).
Existem também os peróxidos e os superóxidos.
Os peróxidos são formados pela união entre dois átomos de oxigênio e um elemento metálico alcalino, alcalino-terroso ou hidrogênio. Nos peróxidos, o oxigênio assume número de oxidação igual a -1. Exemplo: peróxido de hidrogênio (H2O2), mais conhecido como água oxigenada.
Os superóxidos são formados pela ligação entre o oxigênio e um elemento metálico alcalino ou alcalino-terroso. Nessas espécies, o átomo de oxigênio possui número de oxidação igual a -1/2. Exemplo: superóxido de lítio (Li2O4).
Leia também: Teoria ácido-base de Brönsted-Lowry
Carbetos, hidretos e sulfetos
Os carbetos são compostos binários que possuem carbono como um dos elementos e são classificados como materiais cerâmicos. Podem ser iônicos ou covalentes, a depender do outro elemento que os compõe. Exemplo: o carbeto de silício (SiC) é duro e abrasivo, muito utilizado para polimento de objetos.
Os hidretos são compostos binários que possuem o hidrogênio como elemento de maior eletronegatividade, sendo o ânion com estado de oxidação -1. Exemplo: hidreto cálcio (CaH2).
Os sulfetos são formados pelo átomo de enxofre ligado a outro elemento. Nos sulfetos, o enxofre possui estado de oxidação -2. Normalmente, são compostos tóxicos e encontram aplicação em procedimentos industriais. Podem ser encontrados em alguns minerais, como a pirita (FeS2) e a galena (PbS).
Dissociação
O processo de dissociação nada mais é do que a separação de íons que estavam combinados em um composto iônico.
Na dissociação, os íons já existem e apenas são separados quando colocados em água ou quando fundidos. Sais e bases sofrem dissociação iônica.
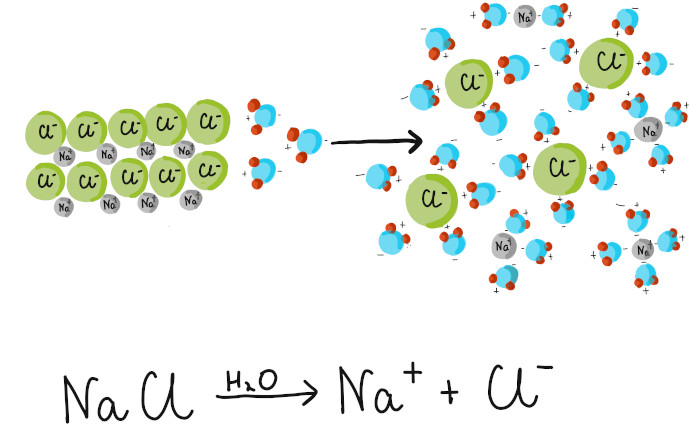
Exemplo de dissociação de um sal:
\(NaCl\ \longrightarrow\ {Na}^++\ {Cl}^-\)
Exemplo de dissociação de uma base:
\({Al(OH)}_3\ \longrightarrow\ {Al}^{3+}+3\ {OH}^-\)
Ionização
O processo de ionização envolve a formação de íons a partir de um composto molecular, ao ser esse composto “atacado” por um solvente.
No caso da ionização, os íons não existiam no composto inicial, mas são efetivamente formados no processo de ionização, por perda e ganho de elétrons para o solvente.
Ácidos são compostos moleculares que sofrem ionização em água:
\(H_2{SO}_4\ \longrightarrow\ {2\ H}^++\ {SO}_4^{2-}\)
É comum a confusão entre ionização e dissociação. Na dissociação, os íons já existem em compostos iônicos e apenas são separados. Na ionização, os íons são formados a partir de compostos moleculares.
Os dois processos são importantes, pois facilitam a ocorrência de reações químicas. Na natureza, boa parte das reações ocorre em solução.
Leia também: Constante de ionização de ácidos e bases
Exercícios sobre funções inorgânicas
Questão 1
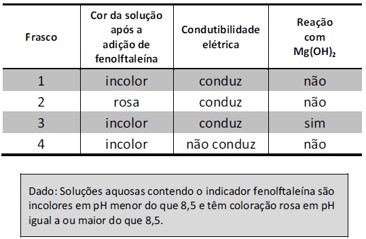
(FUVEST) Em um laboratório químico, um estudante encontrou quatro frascos (1, 2, 3 e 4) contendo soluções aquosas incolores de sacarose, KCl, HCl e NaOH, não necessariamente nessa ordem. Para identificar essas soluções, fez alguns experimentos simples, cujos resultados são apresentados na tabela a seguir:
As soluções aquosas nos frascos 1, 2, 3 e 4 são, respectivamente, de
a) HCl, NaOH, KCl e sacarose.
b) KCl, NaOH, HCl e sacarose.
c) HCl, sacarose, NaOH e KCl.
d) KCl, sacarose, HCl e NaOH.
e) NaOH, HCl, sacarose e KCl.
Resolução:
Letra B.
A solução do frasco 1 permanece incolor, isto é, tem pH menor do que 8,5 (NaOH descartado), conduz eletricidade (sacarose descartada) e não reage com Mg(OH)2 (HCl descartado). Logo, o frasco 1 é KCl.
A solução do frasco 2 fica rosa com fenolftaleína, portanto, é básica. Nesse caso, a única opção é NaOH.
A solução do frasco 3 permanece incolor, isso indica que o pH é menor do que 8,5, que conduz eletricidade (sacarose descartada) e reage com Mg(OH)2 (que é base). Portanto, só pode se tratar do ácido HCl.
A solução que resta para o frasco 4 é a sacarose. As evidências observadas fazem sentido, pois não há alteração de cor, não há formação de solução eletrolítica e nem reação com base. Portanto, a alternativa correta é B.
Questão 2
(ENEM) Nos anos de 1990, verificou-se que o rio Potomac, situado no estado norte-americano de Maryland, tinha, em parte de seu curso, águas extremamente ácidas por receber um efluente de uma mina de carvão desativada, o qual continha ácido sulfúrico (H2SO4). Essa água, embora límpida, era desprovida de vida. Alguns quilômetros adiante, instalou-se uma fábrica de papel e celulose que emprega hidróxido de sódio (NaOH) e carbonato de sódio (Na2CO3) em seus processos. Em pouco tempo, observou-se que, a partir do ponto em que a fábrica lança seus rejeitos no rio, a vida aquática voltou a florescer.
HARRIS, D. C. Análise química quantitativa. Rio de Janeiro: Livros Técnicos e Científicos, 2012 (adaptado).
A explicação para o retorno da vida aquática nesse rio é a
a) diluição das águas do rio pelo novo efluente lançado nele.
b) precipitação do íon sulfato na presença do efluente da nova fábrica.
c) biodegradação do ácido sulfúrico em contato com o novo efluente descartado.
d) diminuição da acidez das águas do rio pelo efluente da fábrica de papel e celulose.
e) volatilização do ácido sulfúrico após contato com o novo efluente introduzido no rio.
Resolução:
Letra D. O retorno da vida aquática se deve à redução da acidez das águas que haviam sido contaminadas pelo resíduo das minas, em razão do contato com a água que continha os resíduos básicos da fábrica de papel e celulose. Na realidade, o que ocorre é uma reação de neutralização entre espécies ácidas e básicas, gerando água e sal com valores de pH próximos a 7.
\(2\ NaOH+\ H_2{SO}_4\ \longrightarrow2\ H_2O+\ {Na}_2{SO}_4\ \ \)
\({Na}_2{CO}_3+\ H_2{SO}_4\longrightarrow\ \ H_2O+\ {CO}_2+\ {Na}_2{SO}_4\ \)

