Química Inorgânica

A Química Inorgânica é a subárea da Química que se dedica ao estudo das propriedades, estrutura e reatividade de compostos inorgânicos formados pelos elementos da Tabela Periódica, com exceção do carbono.
Os compostos contendo carbono como principal elemento fazem parte da área de estudo da Química Orgânica. Já os compostos inorgânicos incluem minerais, metais, ácidos, bases, sais, óxidos e os compostos organometálicos.
As substâncias inorgânicas estão abundantemente presentes em nosso cotidiano, desde a água que ingerimos, o ar que respiramos e as moléculas que transportam oxigênio pela corrente sanguínea. Os compostos inorgânicos e as reações inorgânicas são fundamentais ao funcionamento de diversos processos industriais nos mais variados setores, como as indústrias farmacêutica e alimentícia.
Acesse também: Bases no cotidiano — as aplicações mais comuns de base
Resumo sobre Química Inorgânica
-
A Química Inorgânica é uma das subáreas de estudo da Química.
-
A Química Inorgânica se concentra no estudo das propriedades, estruturas e reatividade dos compostos inorgânicos.
-
Os compostos inorgânicos são aqueles formados pelos diferentes elementos da Tabela Periódica, com exceção do elemento carbono.
-
Minerais, metais, ácidos, bases, sais, óxidos e os compostos organometálicos são compostos inorgânicos.
-
As quatro principais funções inorgânicas em que se dividem os compostos de acordo com as similaridades químicas são: ácido, base, sal e óxido.
-
As reações inorgânicas são os processos de transformação química que ocorrem com os compostos inorgânicos. Classificam-se em: reações de síntese, reações de decomposição, reações de simples troca e reações de dupla troca.
-
As aplicações da Química Inorgânica são diversas, uma vez que ela engloba uma enorme quantidade de compostos.
-
As indústrias química, farmacêutica, alimentícia, têxtil e metalúrgica são apenas alguns dos segmentos que utilizam a Química Inorgânica em seu dia a dia.
O que é Química Inorgânica?
A Química Inorgânica é um dos ramos da Química responsáveis pelo estudo dos compostos inorgânicos, incluindo suas propriedades, estruturas e reações envolvidas.
Em oposição aos compostos orgânicos, os compostos inorgânicos são aqueles que não contêm carbono como principal elemento, englobando as substâncias formadas por todos os demais elementos da Tabela Periódica, incluindo minerais, metais, ácidos, bases, sais, óxidos e compostos organometálicos.
A imagem abaixo representa alguns compostos inorgânicos presentes no dia a dia.

Os compostos organometálicos estão incluídos na Química Inorgânica, e essa área de estudo é considerada uma região de interface entre as químicas Inorgânica e Orgânica, uma vez que explora as propriedades de compostos formados por metal e carbono.
A Química Inorgânica, seus compostos e processos possuem vasta aplicação na indústria química e farmacêutica, na pesquisa científica, na agricultura, nos combustíveis, na área de materiais eletrônicos e magnéticos, além de estar presente em sistemas biológicos.
O que a Química Inorgânica estuda?
→ Funções inorgânicas
Um dos objetos de estudo da Química Inorgânica são as funções inorgânicas. Os compostos inorgânicos são classificados em funções inorgânicas, de acordo com a similaridade de propriedades e de reatividade. Veja a seguir as principais funções inorgânicas.
◦ Ácidos
Os ácidos são compostos covalentes que se ionizam em água, gerando como único cátion o íon H+. Veja a equação de ionização do ácido clorídrico (HCl) em água:
HCl(aq)⟶H+(aq)+Cl−(aq)
A presença de íons H+ em meio aquoso atribui a eles caráter ácido, representado por medidas de pH entre zero e 7. As substâncias ácidas têm como características o sabor azedo e a capacidade de conduzir corrente elétrica quando em solução aquosa.
Os ácidos estão muito presentes em nosso dia a dia. Por exemplo, o ácido clorídrico é o principal componente do suco gástrico. Os ácidos são extensamente utilizados na indústria química para a fabricação de papel, de tecidos, de vidro e de baterias automotivas. Além disso, na agricultura, os ácidos são empregados como fertilizantes e estão também envolvidos na fabricação de explosivos e de alimentos.

Os ácidos podem ser classificados de acordo com a quantidade de hidrogênios ionizáveis, ou seja, quantos hidrogênios são liberados em solução aquosa.
-
Monoácidos: possuem um único hidrogênio ionizável, como o ácido nítrico (HNO3) e o ácido clorídrico (HCl).
-
Diácidos: possuem dois hidrogênios ionizáveis, como o ácido sulfúrico (H2SO4) e o ácido sulfídrico (H2S).
-
Triácidos: possuem três hidrogênios ionizáveis, como o ácido fosfórico (H3PO4) e o ácido bórico (H3BO3).
A força de um ácido é medida em termos do grau de ionização (α). A propriedade de força ácida reflete a taxa de moléculas do ácido que efetivamente se ionizam em água, liberando íons H+. Quanto maior o grau de ionização, mais forte é o ácido.
α=número de moléculas ionizadasnúmero de moléculas dissolvidas
◆ Ácidos fortes: possuem α maior do que 50%. Exemplos: HCl (α = 92,5%), HNO3 (α = 92%).
◆ Ácidos moderados: possuem α entre 5% e 50%. Exemplo: H3PO4 (α = 27%).
◆ Ácidos fracos: possuem α inferior a 5%. Exemplo: H2S (α = 0,076%).
Os ácidos podem ainda ser classificados em função da presença ou não de átomos de oxigênio.
-
Hidrácidos: não possuem oxigênio na sua estrutura.
-
Oxiácidos: possuem oxigênio na molécula.
Leia também: Aplicações dos ácidos mais comuns
◦ Bases
As bases são compostos iônicos que se dissociam em água, liberando como único ânion o íon hidroxila (OH-). O cátion que compõe a base pode variar, mas é comum que seja um cátion metálico. Veja a equação de dissociação do hidróxido de sódio (NaOH) em água:
NaOH(aq)⟶Na+(aq)+OH−(aq)
As substâncias básicas possuem como característica o sabor adstringente (semelhante ao de frutas verdes) e conduzem corrente elétrica quando em solução aquosa. As bases fazem parte de diversos produtos de limpeza, de fármacos, de produtos alimentícios e de cosméticos. O leite de magnésia, por exemplo, é um medicamento utilizado como antiácido e laxante e é composto por hidróxido de magnésio, uma base inorgânica.
A presença de íons OH- em meio aquoso atribui a eles caráter básico ou alcalino, representado por medidas de pH entre sete e 14.
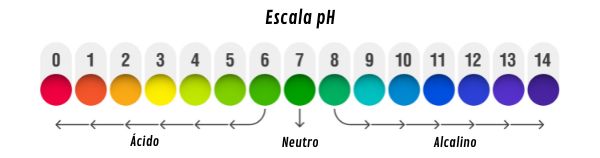
A solubilidade das bases varia de acordo com o cátion formador, sendo insolúveis as bases contendo metais de transição, pouco solúveis as bases formadas por metais alcalinos terrosos e consideradas solúveis aquelas bases formadas por nitrogênio e metais alcalinos.
As bases são classificadas de acordo com a quantidade de hidroxilas dissociáveis, ou seja, a quantidade de íons OH- que podem ser liberados em solução aquosa:
-
Monobases: possuem uma única hidroxila dissociável, como o hidróxido de sódio (NaOH).
-
Dibases: possuem dois íons OH- dissociáveis, como o hidróxido de cálcio (Ca(OH)2).
-
Tribases: possuem três hidroxilas dissociáveis, como o hidróxido de alumínio (Al(OH)3).
A força de uma base é estimada de acordo com seu grau de dissociação (α), que é uma estimativa da quantidade de moléculas da base que efetivamente se dissociam e liberam íons OH- em solução aquosa. Quanto maior o grau de dissociação, mais forte é a base.
α=número de moléculas dissociadasnúmero de moléculas dissolvidas
◆ Bases fortes possuem α superior a 5%. Exemplo: hidróxido de sódio (NaOH) tem α = 95%.
◆ Bases fracas possuem α inferior a 5%. Exemplo: hidróxido de amônio (NH4OH) tem α = 1,5%.
◦ Sais
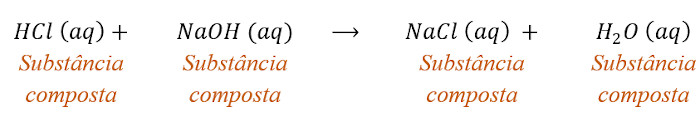
Os sais são compostos iônicos formados por um cátion diferente do íon H+ e por um ânion diferente do íon OH-. Os sais são preparados pela reação entre um ácido e uma base, conhecida como reação de neutralização, que também gera água como produto. Veja a reação entre ácido clorídrico e hidróxido de sódio, que dá origem ao cloreto de sódio (NaCl), e note que o sal formado não possui H+ ou OH-:
HCl+NaOH⟶NaCl+H2O
Os sais são sólidos, possuem sabor salgado e têm estrutura cristalina, característica que lhes atribui elevados pontos de ebulição e de fusão. Quando em solução aquosa, os sais são capazes de conduzir corrente elétrica.
Sendo compostos muito presentes na natureza, os sais são fundamentais para o bom funcionamento de organismos vegetais e animais. O soro fisiológico é uma solução de água e sal. O carbonato de cálcio é o sal que compõe o calcário, o mármore e a calcita, sendo uma importante substância formadora de cavernas, formações rochosas, corais, carapaças de animais, casca de ovos, além de ser indispensável ao cultivo de solos. Diversos tipos de sais são essenciais à fabricação de alimentos, medicamentos, produtos de limpeza e produtos químicos em geral.

A maioria dos sais é considerada solúvel em água. Os sais considerados insolúveis são aqueles formados por ânions sulfeto (S-), carbonatos (CO32-) e fosfatos (PO43-).
Os sais podem ser classificados de acordo com o modo como são formados.
-
Sais ácidos: também chamados de hidrogenossais, são formados pela reação entre um ácido forte e uma base fraca e conseguem diminuir o pH de uma solução.
-
Sais básicos: são derivados da reação entre uma base forte e um ácido fraco e promovem elevação do pH de uma solução.
-
Sais neutros: são derivados da reação química entre uma base e um ácido fortes e não alteram a característica de acidez ou basicidade de um meio.
◦ Óxidos
Os óxidos são compostos formados por apenas dois elementos químicos, sendo um deles o oxigênio. Por isso, são ditos compostos binários.
Eles podem ser classificados de acordo com o modo como são formados.
-
Óxidos iônicos: são formados pela ligação entre o oxigênio e um metal, como o óxido de cálcio (CaO) e hidróxido de ferro (Fe(OH)3).
-
Óxidos moleculares: são constituídos pela ligação entre o oxigênio e um ametal, como o dióxido de carbono (CO2) e o dióxido de nitrogênio (NO2).
Os óxidos são substâncias muito comuns no cotidiano, sendo o hidróxido de ferro, Fe(OH)3, a substância alaranjada que chamamos de ferrugem. O gás carbônico, o CO2, é o gás que expelimos ao respirar e um dos causadores do efeito estufa.
Eles são classificados em função de seu comportamento químico.
◆ Óxidos ácidos: possuem caráter covalente, pois são formados por oxigênio e ametais. Na presença de água, os óxidos ácidos geram ácidos, e em contato com bases, realizam uma reação de neutralização, resultando nos produtos sal e água. O dióxido de carbono é um óxido que forma ácido carbônico (H2CO3) em contato com a água:
CO2(aq)+H2O(l)⟶H2CO3(aq)
◆ Óxidos básicos: possuem caráter iônico e são formados pela união do oxigênio a um elemento metálico. Na reação com ácidos, formam sal e água por se tratar de uma reação de neutralização.
◆ Óxidos neutros: são compostos covalentes de baixa reatividade, não executando transformações químicas na presença de ácidos, bases e nem mesmo água. Os óxidos neutros são formados por metais, a exemplo do monóxido de carbono (CO).
◆ Óxidos anfóteros: apresentam comportamento misto, sendo capazes de atuar como óxido ácido ou como óxido básico, a depender do meio químico. O óxido de alumínio (Al2O3) é um exemplo clássico de óxido anfótero.
Saiba mais: Conceito de ácido, base e sal pela teoria de Arrhenius
→ Reações inorgânicas
As reações inorgânicas são os processos de transformação química que ocorrem com os compostos inorgânicos e é uma das subáreas de estudo da Química Inorgânica. Elas são classificadas em quatro tipos.
◦ Reações de síntese
Nas reações de síntese, dois ou mais reagentes se combinam para formar um único produto. Um bom exemplo de reação de síntese é a preparação da amônia (NH3), espécie química muito empregada em processos industriais e que é obtida pela combinação entre o gás nitrogênio e o gás hidrogênio.
N2(g)+H2(g)⟶2NH3(aq)
◦ Reações de decomposição
Nas reações de decomposição, uma única substância sofre transformação química, dividindo-se em dois ou mais produtos. Por exemplo, o nitrato de cobre é um sal inorgânico que se decompõe em óxido de cobre, dióxido de nitrogênio e gás oxigênio quando aquecido até determinada temperatura.
Cu(NO3)2(s)⟶2CuO(s)+4NO2(g)+O2(g)
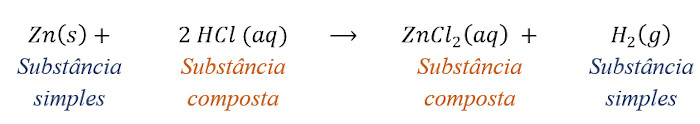
◦ Reações de simples troca
As reações de simples troca ocorrem pela combinação entre uma substância simples e uma substância composta para formar como produtos uma nova substância simples e uma nova substância composta.
◦ Reações de dupla troca
Nas reações de dupla troca, duas substâncias compostas reagem entre si formando outras duas novas substâncias compostas. A reação de neutralização é um exemplo de reação de dupla troca.
→ Compostos de coordenação
Os compostos de coordenação são uma subárea da Química Inorgânica que se concentra no estudo de moléculas constituídas por um elemento central, sendo este um metal ou íon metálico, rodeado por íons ou moléculas, chamadas de ligantes. Os compostos de coordenação também são conhecidos como complexos.
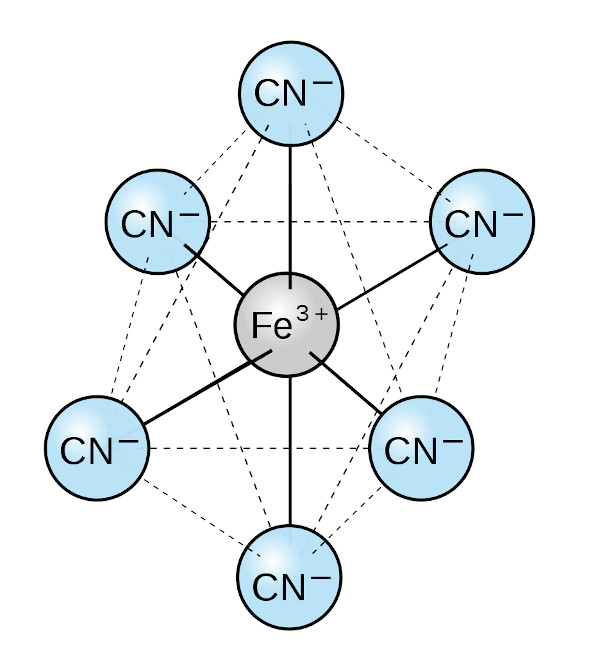
Os ligantes possuem diferentes naturezas químicas, podendo ser a amônia (NH3), o monóxido de carbono (CO), os íons de halogênios (F-, Cl-, Br- e I-), os carbonatos (CO32-), os oxalatos (C2O42-), entre outros.
Quando os ligantes contêm átomos de carbono e estes fazem ligação direta com o metal central do complexo, tem-se uma classe específica dos compostos de coordenação, que são os compostos organometálicos.

No nosso cotidiano, temos compostos de coordenação atuando nos organismos vivos. No corpo humano, a metilcobalamina é um complexo inorgânico formado por um núcleo de cobalto ligado a ligantes orgânicos e é mais conhecida como vitamina B12.
O transporte de oxigênio pela corrente sanguínea é realizado por um composto de coordenação, chamado hemoglobina, que é uma metaloproteína que contém íons ferro unidos às cadeias polipeptídicas (atuam como ligantes). O ferro da hemoglobina se liga fracamente e reversivelmente ao oxigênio, permitindo o seu transporte pelo organismo.
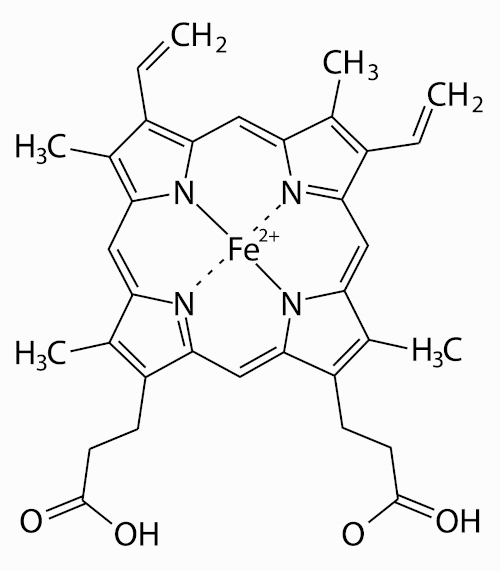
A fotossíntese executada pelas plantas também atua pela ação de compostos de coordenação.
Muitos compostos de coordenação são empregados em estudos avançados de Química e na área industrial, com diferentes funções, atuando como catalisadores de processos químicos, na composição de pigmentos, na síntese de medicamentos, ente outros usos.
Veja também: Compostos de Grignard — os organometálicos constituídos pelo elemento magnésio
Aplicações da Química Inorgânica
Como muitos produtos químicos básicos requeridos nos processos industriais são compostos inorgânicos ― como ácidos, bases, sais, agentes oxidantes e halogênios ―, as substâncias inorgânicas possuem aplicação em todos os setores da indústria química, englobando a fabricação de pigmentos, revestimentos, fármacos, catalisadores, surfactantes, produtos de limpeza, dispositivos eletrônicos, agricultura e outros.
A indústria cloro-álcali é um importante segmento da indústria química mundial, em razão de sua relevância econômica. Esse segmento deriva da reação do cloreto de sódio aquoso (via eletrólise) em hidróxido de sódio, cloro gasoso e gás hidrogênio.
NaCl+H2O⟶NaOH+1⁄2H2+1⁄2Cl2
Os produtos gerados nessa reação são as matérias-primas para fabricação de uma infinidade de outras substâncias, como os polímeros, os produtos de limpeza à base de cloro, aditivos de lavouras, pigmentos e tintas, dispositivos eletrônicos e elétricos.
Importância da Química Inorgânica
No planeta Terra existem cerca de 100 mil compostos inorgânicos diferentes. Essa diversidade deriva da capacidade de combinação dentre os elementos químicos da Tabela Periódica, com exceção do carbono.
A Química Inorgânica é importante pois engloba os estudos sobre as propriedades e características de uma enorme quantidade de compostos, metais e minerais que fazem parte da vida no planeta, como a água, os gases do ar que respiramos e os minérios que originam os metais empregados na construção de edifícios, de objetos e de dispositivos eletrônicos.
Os avanços na agricultura e no setor farmacêutico registrados nas últimas décadas têm influência dos avanços tecnológicos na área de pesquisa em Química Inorgânica.
Os avançados sistemas atuais de geração e armazenamento de energia, transmissão rápida de dados com o uso de semicondutores e a nanotecnologia ocorrem em razão do conhecimento construído acerca de substâncias inorgânicas.
Além disso, muitos compostos inorgânicos são usados nas reações executadas no setor industrial. Inclusive, reações orgânicas podem empregar reagentes e catalisadores inorgânicos, como os metais e os compostos organometálicos.
Diferenças entre Química Inorgânica e Química Orgânica
A diferença principal entre Química Inorgânica e Orgânica é, basicamente, os compostos que cada uma dessas áreas se dispõe a estudar.
-
Química Inorgânica: é conhecida como Química mineral e se ocupa do estudo das substâncias formadas por todos os elementos químicos da Tabela Periódica, com exceção do carbono.
-
Química Orgânica: se ocupa do estudo dos compostos formados majoritariamente por átomos de carbono. Essa subdivisão da Química é conhecida também como Química da vida ou estudo das coisas vivas, uma vez que grande parte das moléculas que compõem os organismos vivos são compostos orgânicos.
História da Química Inorgânica
A exploração de compostos inorgânicos se deu muito antes do conhecimento da própria Química como uma ciência. Os primeiros compostos inorgânicos explorados pelos seres humanos foram os metais, em 3300 a 1200 a.C., empregados para a construção de objetos, como armas e facas.
Os humanos ancestrais evoluíram em conhecimento e aprenderam a manipular os metais e a misturá-los, o que levou à obtenção da liga metálica que conhecemos como bronze. Esse período histórico é conhecido como Idade do Bronze.
Milhares de anos depois, em 1200 a.C. a humanidade descobriu o ferro, o que levou à obtenção de outra liga metálica, o aço, ainda mais forte do que o bronze. Esse período ficou conhecido como Idade do Ferro.
Ao longo da história, os metais preciosos, como o ouro e a prata, ganharam grande destaque e motivaram inúmeras guerras e conflitos. Os alquimistas, considerados os precursores dos cientistas, passaram décadas na tentativa de encontrar a fórmula para a conversão do chumbo em ouro. Os alquimistas não alcançaram esse objetivo, mas fizeram diversas contribuições para a Química moderna, como o descobrimento das primeiras substâncias ácidas e básicas.
Esse grupo de estudiosos também contribuiu para o avanço da metalurgia e de processos de extração de metais advindos dos minérios. Os primeiros elementos químicos também foram isolados e descritos durante o período dos alquimistas.
Um dos compostos inorgânicos mais antigos conhecidos é o azul da Prússia (KFe2(CN)6), que é um composto de coordenação e importante pigmento utilizado desde a Antiguidade e que passou milhares de anos sem interpretação sobre seu comportamento químico.
A compreensão sobre muitas substâncias inorgânicas e, principalmente, sobre os compostos de coordenação e os compostos organometálicos apenas foi ampliada no início do século XX, com o desenvolvimento do campo moderno da Química de coordenação.
Esse avanço científico foi proporcionado pelo trabalho de Alfred Werner (cientista que recebeu o Prêmio Nobel de Química em 1913 pelas suas contribuições) e também pelos estudos de Sophus Mads Jorgensen.
Anos mais tarde, a Química Inorgânica registrou novos avanços científicos, impulsionada pela Segunda Guerra Mundial. No período pós-guerra, diversas teorias e conhecimentos da Química Inorgânica foram aprimorados, derivando as teorias de campo cristalino e teoria de campo ligante aplicadas aos compostos de coordenação, as quais são muito relevantes em estudos avançados.
Mais recentemente, em meados de 1950, a descoberta de catalisadores organometálicos abriu um novo campo de expansão para processos químicos já conhecidos, como o processo Haber-Bosch, empregado para a geração de amônia por meio de gases hidrogênio e nitrogênio. A importância disso se deve à relevância que compostos derivados de amônia possuem na fabricação de fertilizantes agrícolas, que são produtos de alta demanda mundial para a produção de alimentos.
Atualmente, o ferro, o aço, o cobre, o zinco, a prata, o ouro e os demais metais possuem uma importância incalculável para a humanidade, fazendo parte da estrutura de casas e edifícios, automóveis, equipamentos industriais, objetos, dispositivos de tecnologia e até mesmo servindo como moeda de troca e reserva de valor financeiro.
Ferramentas Brasil Escola
Seções de Química Inorgânica
Artigos de Química Inorgânica

Últimas notícias
Outras matérias


















