Transformação adiabática

Transformações adiabáticas são processos termodinâmicos nos quais não ocorrem transferências de calor entre um sistema e suas vizinhanças. As únicas trocas de energia possíveis durante um processo adiabático são decorrentes da realização de trabalho termodinâmico. A palavra “adiabática” deriva do grego adiabato, que significa impenetrável ou intransponível.
O que é transformação adiabática?
A transformação adiabática ocorre quando um gás expande-se ou sofre compressão com velocidade rápida o suficiente para que as trocas de calor entre ele e suas vizinhanças sejam desprezíveis. Durante uma transformação adiabática, os gases podem sofrer variações de temperatura, por exemplo, ao apertarmos um spray aerosol, o gás que está confinado em alta pressão é expelido em alta velocidade. Sua temperatura, então, cai bastante em virtude da enorme queda de pressão que o gás sofre ao deixar seu recipiente.
De acordo com a 1ª lei da Termodinâmica, também conhecida como conservação da energia, podemos dizer que, para qualquer sistema físico:
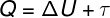
Q – calor
ΔU – variação da energia interna
τ – trabalho termodinâmico
A expressão mostrada acima diz que a quantidade de calor (Q) fornecida a um sistema pode ser parcialmente transformada em trabalho (τ). O restante da quantidade de calor será transformada em um acréscimo de energia interna desse corpo (ΔU), causando, como consequência, um aumento em sua temperatura.
Veja também: 1ª lei para processos adiabáticos
Nas transformações adiabáticas, não há trocas de calor. Dessa forma, a 1ª lei da Termodinâmica indica que toda variação de energia interna de um gás durante um processo adiabático deve ser igual ao trabalho realizado pelo ou sobre o gás:
No caso do aerosol, como o gás sofre uma expansão e empurra as moléculas do ar atmosférico à sua volta, ele mesmo consome parte de sua energia interna realizando trabalho.
|
Nos processos adiabáticos, as únicas trocas de energia possíveis entre um sistema e suas vizinhanças ocorrem por meio da realização de trabalho. |
Veja também: Trabalho de um gás
Compressão e expansão adiabática
Compressões e expansões adiabáticas são comuns em motores de combustão interna, como motores movidos a gasolina, os quais funcionam a partir do ciclo Otto. Esse ciclo é composto por quatro etapas:
-
Admissão isobárica: há um grande aumento no volume do gás sob pressão constante.
-
Compressão adiabática: há um grande aumento na pressão do gás e uma diminuição de seu volume sem que haja trocas de calor.
-
Expansão adiabática: há um grande aumento no volume do gás e uma diminuição da pressão sem que haja trocas de calor.
-
Expansão isobárica: há um aumento no volume do gás sob pressões constantes.
A compressão adiabática ocorre, portanto, quando um gás sofre uma diminuição em seu volume e, consequentemente, um aumento em sua pressão sem que se realizem trocas de calor com suas vizinhanças.
A expansão adiabática, por sua vez, é caracterizada por um aumento repentino no volume do gás e uma grande queda de sua pressão. Dessa forma, a temperatura do gás tende a cair rapidamente, mesmo sem haver trocas de calor entre o gás e o meio.
Pressão e volume nas transformações adiabáticas
É possível relacionar a pressão e o volume de um gás durante uma transformação adiabática por meio da seguinte equação:
Pi – pressão inicial
PF – pressão final
Vi – volume inicial
VF – volume final
γ – coeficiente de expansão adiabática
Na equação acima, γ representa o coeficiente de expansão adiabática, uma grandeza adimensional definida pela razão entre o calor específico molar a pressão constante (CP) e o volume constante (CV). Observe:
CP – calor específico molar a pressão constante
CV – calor específico molar a volume constante
Para gases ideais monoatômicos, o coeficiente γ tem valor igual a 5/3. Já para gases ideais diatômicos, seu valor é de 7/5. A relação entre calor específico de pressão constante e volume constante é chamada de relação de Mayer. Observe:
R – constante universal dos gases perfeitos (0,082 atm.L/mol.K ou 8,31 J/mol.K)
Gráfico das transformações adiabáticas
Os ciclos termodinâmicos são apresentados em forma de gráficos, os quais, geralmente, relacionam as grandezas pressão e volume. Dessa forma, é necessário que saibamos identificar a curva relativa às transformações adiabáticas nesse tipo de gráfico:
As curvas relacionadas às transformações adiabáticas são mais acentuadas que as curvas isotérmicas.
Fórmulas da transformação adiabática
As principais fórmulas utilizadas para o estudo das transformações adiabáticas são:
A equação acima pode ser reescrita em termos da pressão e temperatura. Confira:
Além disso, existe uma fórmula para calcularmos o coeficiente de expansão adiabática:
Para determinarmos a relação entre CP e CV:
Exemplos resolvidos sobre transformação adiabática
Um gás ideal de volume V1 e temperatura inicial T1 sofre uma expansão adiabática até que seu volume final seja 9 vezes maior que seu volume inicial, sua pressão final P2 e sua temperatura final T2. Sendo CP/CV = 3/2 para esse gás, determine:
a) a razão entre as pressões iniciais e finais desse gás.
b) a razão entre as temperaturas finais e iniciais desse gás.
Resolução
a) Para encontrarmos as relações entre as pressões P1 e P2 do gás, podemos utilizar a equação a seguir:
Como informa o exercício, o volume final do gás (V2) é 9 vezes maior que o volume inicial V1. Portanto, V2 = 9V1:
b) Para calcularmos a relação entre as temperaturas do gás, podemos utilizar a lei geral dos gases ideais:



