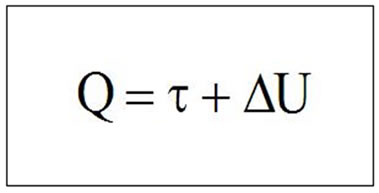Primeira Lei da Termodinâmica
Ao estudar alguns fatos históricos sobre a busca de novas fontes de energia e formas de realização de trabalho percebemos que o homem utilizou diversos recursos. Em função dessas descobertas vimos que tanto o calor como o trabalho e a energia interna são formas de energia e que, pelo que conhecemos de sistemas mecânicos, a energia se conserva e existe uma relação entre trabalho e energia.
Com base nos estudos realizados no decorrer da história, vimos que a Primeira Lei da Termodinâmica trata do balanço energético entre as energias inicial e final do sistema, a energia fornecida e o trabalho realizado pelo sistema, ou seja, podemos afirmar que em qualquer processo termodinâmico analisado, a quantidade de calor Q recebida pelo sistema é igual ao trabalho realizado por ele mais a variação da energia interna.
Assim, podemos expressar a primeira lei da termodinâmica, em termos matemáticos, da seguinte maneira:
Q = T + ΔU
A primeira lei da termodinâmica refere-se a um processo, pois tanto o trabalho quanto o calor não podem ser medidos ou calculados para um único estado termodinâmico. Essas duas grandezas só têm significados quando medidas em instantes diferentes.
Ao referirmos à primeira lei da termodinâmica podemos dizer que ela nada mais é do que a lei da conservação da energia, ou seja, em um processo termodinâmica, a energia total de um sistema se conserva. Dessa forma, podemos dizer que quando o sistema recebe calor, ele pode variar a energia interna e/ou realizar trabalho. Por exemplo, quando colocamos um recipiente com gás sobre uma chama, o gás se expande realizando trabalho e aumenta sua temperatura, ou seja, aumenta sua energia interna.
Nesse tipo de processo termodinâmico, parte do calor que o gás recebe é transformado em energia interna e parte desse calor é utilizado para realizar trabalho termodinâmico. Assim, a soma dessas duas parcelas é igual ao calor recebido, pois sabemos que a energia não pode ser criada e nem destruída, mas apenas transformada. Com isso podemos definir que um determinado gás realiza trabalho quando seu volume aumenta (T positivo). Quando seu volume diminui, o trabalho é realizado sobre o gás (T negativo).
Por Domiciano Corrêa Marques da Silva
Graduado em Física