Ligação Covalente e o Modelo de Linus Pauling com os Orbitais
A primeira ideia de ligação covalente foi tida em 1916, quando Lewis propôs que os átomos se ligavam por meio de pares eletrônicos, ou seja, haveria um compartilhamento de elétrons. Esse tipo de ligação é feita por átomos que têm a tendência de receber elétrons como o hidrogênio, os metais e os ametais.
No entanto, com a evolução do modelo atômico e do seu entendimento, sabe-se que o átomo tem uma propriedade de onda-partícula e, por isso, conforme diz o Princípio de Heisenberg, não é possível determinar com a mesma exatidão a posição e a velocidade de um elétron num átomo. Desse modo, hoje em dia se consideram regiões na eletrosfera, denominadas orbitais, em que é máxima a probabilidade de se encontrar um elétron.
Portanto, atualmente a ligação covalente é vista como a interpenetração dos orbitais.
Linus Pauling, em 1960, propôs um modelo de ligação covalente em que a formação de pares eletrônicos se daria por meio da interpenetração de orbitais incompletos.
Conforme visto no texto “Modelo de Orbitais”, cada orbital é representado por um quadrado que é preenchido por setas que representam os elétrons daquele orbital. Além disso, a quantidade máxima de elétrons que cabem em cada orbital são dois elétrons. Portanto, um orbital incompleto é aquele que não foi preenchido com os dois elétrons. Lembre-se também que o orbital do tipo s é uma esfera e do tipo p é um duplo ovoide.
Para entender como ocorre essa ligação por interpenetração de orbitais incompletos, vejamos dois exemplos. O primeiro que veremos é a ligação entre dois átomos de hidrogênio para a formação do gás hidrogênio (H2):
Modelo de Lewis: visto que o hidrogênio tem apenas uma camada eletrônica, a camada K, ele precisa de dois elétrons para ficar com configuração do gás nobre hélio e, assim, ficar estável. Portanto, pelo modelo de compartilhamento de elétrons, os dois átomos de hidrogênio compartilham um elétron e ambos ficam com dois elétrons, ficando estáveis
.jpg)
- Modelo de Pauling com os orbitais: o hidrogênio faz ligação do tipo s, assim a representação de cada um dos seus átomos é dada por:
Visto que os dois átomos de hidrogênio apresentam o orbital incompleto, preenchido com apenas um elétron, eles precisam de mais um elétron para preencher totalmente o orbital. Assim, há a interpenetração ou fusão desses dois orbitais, formando a molécula de H2:
Nesse caso ocorreu uma ligação covalente sigma s-s (σs-s).
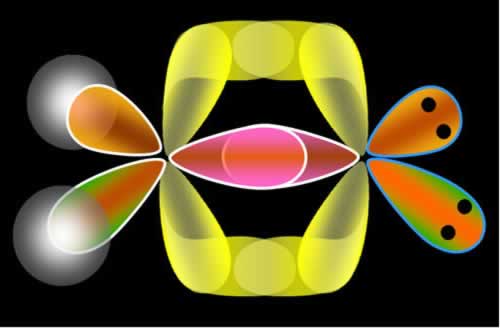
2º Exemplo: Ligação entre hidrogênio e flúor pelo modelo de Pauling com orbitais:
O orbital do hidrogênio nós já sabemos qual é, agora vejamos qual é o do flúor:
Observe que o orbital incompleto do flúor corresponde ao orbital pz, portanto, é nesse orbital que ocorrerá a ligação covalente por fusão com o orbital incompleto do tipo s do hidrogênio:
Nesse caso tivemos uma interpenetração entre um orbital s e um p, assim, temos que essa é uma ligação sigma s-p (σs-p).
Esse modelo de orbitais explica satisfatoriamente as propriedades e características da maioria das ligações covalente entre vários elementos. No entanto, no caso do carbono, esse modelo não se encaixava e foi necessária a criação de um novo modelo, que ficou conhecido como Teoria da Hibridização.



